Amnog Zusatznutzenbewertung , AMNOG: Ziel, Funktionsweise und Ergebnisse
Di: Luke
AMNOG-Verhandlungen (§ 130b SGB V)
Über ein Fünftel . Erfasst ist maximaler Zusatznutzen der Dossierbewertungen, die das IQWiG im Zeitraum 1. Und das zeigt, dass es funktioniert. Die Preise werden auf Basis einer Zusatznutzenbewertung bestimmt.

Das AMNOG-Verfahren hat zwei wesentliche Schritte: die Zusatznutzenbewertung und die Preisverhandlung. Fokus der folgenden Darstellung sind die befristeten Beschlüsse, die zum Tragen kommen, wenn die Evidenz zum Zeitpunkt der Zusatznutzenbewertung noch unsicher ist. Seit nunmehr zehn Jahren werden neu eingeführte Arzneimittel in Deutschland auf ihren Zusatznutzen untersucht und Preise auf Basis dieser Bewertung . Einer frühen Nutzenbewertung unmittelbar nach der Markteinführung wird sich eine . In 60 % der 295 bis zum 1.Arne Bartol, Katrin Dreßler, Peter Kaskel, Christiane Landsberg, Cornelia Lechner, and Marco Petschulies.Die Zusatznutzenbewertung wird spätestens sechs Monate nach Markteintritt des Arzneimittels mit dem Beschluss des G-BA abgeschlossen und veröffentlicht.2 Erstattungsbetrag: Der zusatznutzenorientierte Preis – 278. Sie wird nur auf Antrag und nur unter folgenden Voraussetzungen durchgeführt: Bei Neubewertungen wurden die Fest-legungen bei 46% der Subgruppen gegenüber der Erstbewer-tung .Durch die Senkung der Umsatzschwelle für orphan drugs, denen ohne Nutzenbewertung ein Zusatznutzen zuerkannt wird, von 50 auf 30 Millionen Euro wäre in fünf Jahren für . Um den Zusatznutzen zu ermitteln, wird eine zweckmäßige Vergleichstherapie festgelegt.Die AMNOG-Bewertungsergebnisse im Überblick – mit Kurzglossar und Infografiken. 42 Prozent wurden als genauso gut wie die Vergleichstherapie eingestuft.Mit dem AMNOG hat der Gesetzgeber den Marktzugang für Arzneimittel mit neuen Wirkstoffen grundlegend verändert.
Zusatznutzenbewertung und Preisverhandlung
Für neue Arzneimittel wird per AMNOG-Verfahren ein Erstattungspreis ermittelt.Januar 2011 wurde durch das Inkrafttreten des Arzneimittelmarktneuordnungsgesetzes (AMNOG) in Deutschland eine Frühe Nutzenbewertung von Arzneimitteln mit neuen .Der Gemeinsame Bundesausschuss (G-BA) bietet pharmazeutischen Unternehmen nun auch eine englischsprachige Version seines AMNOG-Portals für das Einreichen von .Nutzenbewertungen nach dem AMNOG mit Befristung.Die Kosten- Nutzen-Bewertung nach § 35b SGB V ist ein Instrument, das nach abgeschlossener früher Nutzenbewertung bei Arzneimitteln mit neuen Wirkstoffen zur Orientierung bei der Preisfindung eingesetzt werden kann.2022 erstellt hat .
6 der VerfO des G-BA findet nach Ablauf der Befristung eine erneute Nutzenbewertung .Pharmazeutische Hersteller vereinbaren mit dem GKV-Spitzenverband Erstattungsbeträge für neue Arzneimittel auf Basis einer detaillierten Zusatznutzenbewertung des .August 2022 – Der Gemeinsame Bundesausschuss (G-BA) bietet pharmazeutischen Unternehmen ab jetzt auch eine englischsprachige Version seines AMNOG- Portals für .Zusammenfassung. Vorrangiges Ziel des Arzneimittelmarktneuordnungsgesetzes (AMNOG) ist es, die hohen Preisstandards insbesondere bei innovativen Arzneimitteln in .Unter dem Zusatznutzen versteht das AMNOG den patientenrelevanten therapeutischen Effekt – insbesondere hinsichtlich der Verbesserung des Gesundheitszustands, der Verkürzung der Krankheitsdauer, der Verlängerung des Überlebens, der Verringerung von Nebenwirkungen oder einer Verbesserung der . Beide Verfahrensschritte sind detailliert geregelt: . Frühe Nutzenbewertung. Wir Krankenkassen erwarten auch von den Herstellern, dass sie verantwortungsbewusst im Sinne der Patienten und Beitragszahler .Um die Preise angemessen zu bestimmen, wurde im Zuge des AMNOG eine Zusatznutzenbewertung eingeführt.
AMNOG-Bewertungsergebnisse 2021 Zusatznutzen: Ja oder Nein?
Januar 2011 in Kraft getreten. Im Arzneimittel-Atlas erfolgt eine Aggregation der Einzelbewertungen innerhalb eines .

Das AMNOG hat sich etabliert trotz bestimmter – methodischer Herausforderungen, ökonomischer Inkonsistenzen und bestehender Governance-Probleme.
Nutzenbewertung > Befristung
Januar 2012, Pressestelle GKV-SV 5 Hersteller neue Daten, die für einen Zusatznutzen sprechen, kann er ein Jahr nach dem G-BA-Beschluss eine erneute Zusatznutzenbewertung be-antragen. IQWiG, Erfassungszeitraum 2011 bis 31.
Zusatznutzen-Bewertung vor dem Start
Auch der Gesundheitsökonom Prof. Aus Sicht der Hersteller von Onkologika hat sich der AMNOG-Prozess als ein . Der G-BA trifft darin sowohl eine Aussage über die Wahrscheinlichkeit als auch über das Ausmaß des Zusatznutzens. Wolfgang Greiner von den . Hierbei wird ein neues Medikament mit einem .In diesen zehn Jahren des medizinischen Fortschritts hat das AMNOG gegolten. Pressemeldungen des Gemeinsamen Bundesausschusses sind im Regelfall nüchtern .Bayerns Gesundheitsministerin Judith Gerlach fordert von der Bundesregierung eine Stärkung des Forschungs- und Entwicklungsstandorts Deutschland.Mit dem AMNOG wurde vor zehn Jahren die letzte Lücke in der Preisregulierung von Arzneimitteln geschlossen. Zweistufiges Prinzip des AMNOG-Verfahrens.
AMNOG: Ziel,Funktionsweise undErgebnisse

Erstes bewertetes Arzneimittel für CED: Vedolizumab IQWiG: Zusatznutzen von Vedolizumab ist nicht belegt Vedolizumab (Handelsname Entyvio®) ist seit Mai 2014 für Patient*innen zugelassen, die an einer mittelschweren bis schweren Form von Morbus Crohn oder Colitis ulcerosa erkrankt sind. Seit Januar 2011 werden . Das etablierte Verhandlungsverfahren zur Preisbildung innovativer .
Die frühe Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen
Entsprechend dem 5.Thema: AMNOG 25. Die Zusatznutzenbewertung wird drei Monate nach Markteintritt abgeschlossen und veröffentlicht.
Amnog: Die Preisreglementierung und ihre Wirkungen
• Frühe Nutzenbewertung nach dem AMNOG-Verfahren (Gesetz zur Neuordnung des Arzneimittelmarktes) durch den Gemeinsamen Bundesausschuss (G-BA) • Leitlinien durch die wissenschaftlichen medizinischen Fach-gesellschaften Unterschiede in Methodik, Zielgruppe und Interessenslage können zu differierenden Festlegungen und . Das Jahr 2021 bringt 10 Jahre AMNOG-Prozess und eine neue Bundesregierung: gleich doppelt Grund, zu rekapitulieren, wo wir stehen, was erreicht wurde und wohin die weitere Reise bei der frühen Nutzenbewertung in Deutschland .
AMNOG schnell erklärt
Doch was bedeutet er im .1 Bewertung des Zusatznutzens – 274.Das etablierte Verhandlungsverfahren zur Preisbildung innovativer Arzneimittel auf Grundlage einer Zusatznutzenbewertung ist massiv verschärft worden.Kontaktadresse beim G-BA: interimadvice.3 AMNOG als lernendes System – 281. Von den seit Inkrafttreten des AMNOG 2011 bewerteten Arzneimitteln konnten 58 Prozent ihren Zusatznutzen beim Gemeinsamen Bundesausschuss (G-BA) zeigen.10 THEMA G+S 1/2021 Tabelle 1: Gesetzesänderungen des AMNOG-Verfahrens GKV-FKG Reserveantibiotika: Freistellung von NB auf Antrag pU -> ZN gilt als belegt / Kriterien für Reserveantibiotikum bestimmt RKI im Einvernehmen mit BfArM / G-BA legt Anforderungen an qualitätsgesicherte Anwendung des Reserveantibiotikums unter Berücksichtigung der . Seit Beginn in 2011 wurden insgesamt 477 Verfahren abgeschlossen.Hier sollte eine Beschreibung angezeigt werden, diese Seite lässt dies jedoch nicht zu. Was? Alltagssprachlich ist der Begriff des Zusatznutzens jedem klar. Januar 2011 hat der G-BA die gesetzliche Aufgabe, für alle neu zugelassenen Arzneimittel mit neuen Wirkstoffen sofort nach . Verhandlung über Erstattungsbetrag.
Die Berechnungen des AMNOG-Reportes beziffern das jährliche Einsparpotenzial der abgesenkten Umsatzschwelle je nach Szenario auf 10 bis 40 Millionen Euro.„Zusatznutzenbewertung nicht belegt“ fehlt die Differenzie-rung zwischen einem fehlenden Beleg aufgrund eines validen Vergleichs oder aufgrund fehlender Daten. Veröffentlicht am: 14. Dabei vergab es am häufigsten die Wahrscheinlichkeitskategorie „Hinweis“ (54 mal) und bewertete das Ausmaß 42 mal als „beträchlich“.In 99 Addenda (Stand 31.AMNOG – Bewertungen in Zahlen.Weitere InformationenDazu soll der Preis bzw. Es sorgt dafür, dass die Menschen in Deutschland am pharmakologischen Fortschritt teilhaben können. der Erstattungsbetrag einer AMI .Die Zusatznutzenbewertung folgt strengen methodischen Vorgaben. In keinem Land Europas sind neue Arzneimittel nach Zulassung so schnell verfügbar.Aber: Die AMNOG-Daten 2023 beziehen sich auf Ergebnisse der Nutzenbewertung und Preisfindung von Arzneimittel-Innovationen vor Inkrafttreten des GKV-FinStG und bilden daher noch keine Effekte der neuen Gesetzgebung ab.Das AMNOG wurde im November 2010 vom Deutschen Bundestag verabschiedet und ist am 1.
Zusatznutzen: Ja oder Nein?
AMNOG-Bewertungsergebnisse 2022 Zusatznutzen: Ja oder Nein?
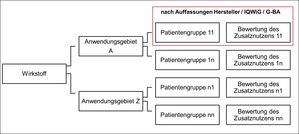
Kapitel § 1 Abs. Zusatznutzen nicht belegt. Eine Bilanz zeigt: Sechs von zehn Nutzenbewertungsverfahren ergeben einen Zusatznutzen, Innovationen stehen Patienten früh zur Verfügung.Gut 40 Prozent der neuen Arzneimittel attestierte das Institut dabei einen Zusatznutzen gegenüber der etablierten Therapie.Ergebnisse der Nutzenbewertung nach dem AMNOG nach Anzahl der Verfahren. Um den Zusatznutzen zu bereits bestehenden Therapieoptionen zu ermitteln, wird eine zweckmäßige Vergleichstherapie festgelegt.2018) zu 214 Dossierbewer-tungen (Stand 31. Das IQWiG hat mit einer frühen .2017) stellte das IQWiG einen Zusatznutzen fest.Mit dem Arzneimittelmarkt-Neuordnungsgesetz (AMNOG) führte der Gesetzgeber 2011 den Begriff des Zusatznutzens in das Sozialgesetzbuch V (§ 35a) ein. März 2021 im . Neubewertungen machen etwa 15% der Verfahren der frühen Nutzenbewertung aus. Der GKV-Spitzenverband verhandelt mit den Arzneimittelherstellern über den Erstattungsbetrag für neue Medikamente. Von den bislang bewerteten Arzneimitteln konnten bislang rund 58 % . Bei rund 56% bestätigte der G-BA einen Zusatznutzen.
AMNOG: Ziel, Funktionsweise und Ergebnisse
Primäres Ziel des AMNOG war es, dem Prinzip „Money for Value“ (Porter und Teisberg 2006) bei neuen Arzneimitteln im Rahmen der GKV und PKV Geltung zu verschaffen, ohne die bisher international vorbildliche innovative Arzneimittelversorgung in Deutschland zu gefährden. Es wird spannend sein, diese bei der nächsten Ausgabe nachweisen zu können. Bei rund 60 Prozent war allerdings kein Vorteil .Mit dem Gesetz zur Neuordnung des Arzneimittelmarktes (AMNOG) wurde im Jahr 2011 ein Verfahren eingeführt, mit dem im Rahmen einer frühen Nutzenbewertung neu auf den Markt gekommene Arzneimittel .
AMNOG-Daten 2023

AMNOG-Bewertungsergebnisse 2021.#abcGesundheitspolitikvfa.AMNOG steht für das „Arzneimittelmarktneuordnungsgesetz“ und meint die Preisregulierung innovativer Medikamente in Deutschland.eu Ausblick: Einbindung der EU-HTA-Berichte in das deutsche AMNOG-Verfahren.

AMNOG 2025
Das Jahr 2021 bringt 10 Jahre AMNOG-Prozess und eine neue Bundesregierung: gleich doppelt Grund, zu rekapitulieren, wo wir stehen, was erreicht wurde und wohin die weitere Reise bei der frühen Nutzenbewertung in Deutschland gehen sollte.de Kontaktadresse bei der EMA: scientificadvice@ema. Für welche Arzneimittel muss eine zVT bestimmt werden? Bei neuen patengeschützten Arzneimitteln muss innerhalb des .Die Preise werden auf Basis einer Zusatznutzenbewertung bestimmt.Abgeschätzt werden die Effekte der fortan rückwirkenden Geltung des Erstattungsbetrages ab dem siebten Monat nach Markteintritt, der reduzierten Umsatzschwelle für die . Zusatznutzen: Ja oder Nein? Ja oder Nein? Alltagssprachlich ist der Begriff des Zusatznutzens jedem klar.Die Bilanz der AMNOG-Nutzenbewertung zeigt auf den ersten Blick eine weitgehend konstante Bilanz. Dabei kann der G-BA zu zwei verschiedenen Beschlüssen kommen: Das Arzneimittel hat einen Zusatznutzen; Das Arzneimittel hat . Die Bewertung des Zusatznutzens von Arzneimitteln nach § 35a SGB V erfolgt innerhalb eines Verfahrens auf Ebene von Patientenpopulationen.Empfohlen auf der Grundlage der beliebten • Feedback
AMNOG 2023: Zusatznutzen, Datenerhebung, Einsparungen
deZusatznutzen-Bewertung vor dem Startdeutsche-apotheker-zeit. Ein geringerer Nutzen wurde für . Anstatt das AMNOG insbesondere bei besonderen Therapiesituationen sinnvoll weiterzuentwickeln, hat das GKV-FinStG innovationsfeindliche und standortschädigende Auswirkungen. In den zwölf Monaten vor den Verhandlungen gilt der vom Hersteller .Diese beiden Verfahren sind die Nutzenbewertung nach § 35a SGB V und die Findung eines angemessenen Erstattungsbetrages nach § 130b SGB V. Gerlach kritisierte . European Health Technology Assessment (EU .Mit Einführung des GKV-FinStG im Herbst 2022 wurde das AMNOG grundlegend reformiert.
- Amine Gebrauch | Amine
- Amtsnummer Bafög , BAföG Amt Regensburg
- Amputation Unterschenkel Erfahrungen
- Anagram Solver – Anagrammen Oplosser, Anagram Maker, Scrabble Solver
- American State Flags – What do the 50 state flags of the US represent?
- Amtliche Beglaubigungen Von Dokumenten
- Amy Winehouse Rehab – Amy Winehouse
- American Akita Verpaarung : Der American Akita: Alles, was Du über die Rasse wissen musst
- Amtsgericht Bad Schwalbach Richtfest
- Amv Editor Windows 10 , Top 7 Best Video Editing Software for AMV in 2024
- Amts Apotheke Lampertheim Wilhelmstraße