Brom Oxidationen , Chemie Klasse 8/9: Thema
Di: Luke
Nachweis als Brom und Iod [Bearbeiten].netEmpfohlen auf der Grundlage der beliebten • Feedback
Redoxreaktion einfach erklärt • Oxidation, Reduktion
Redoxreaktionen: Grundlagen.Die Oxidation ist in der Chemie eine sehr wichtige Reaktion. Stoff A ist hier das . Definition Oxidation und Reduktion. So werden bei den Säure-Base-Reaktionen von den Säuren Protonen abgegeben und von den Basen diese aufgenommen.Es ist das Oxidationsmittel, weil bei der Reaktion ein anderes Atom oxidiert wird.deBrom – DocCheck Flexikonflexikon.Gefahrenhinweise.: 0) die Manganometrie, welche Permanganationen als Oxidationsmittel verwende. *3 Oxidationsstufe als Zentralatom eines Komplexes. Einige Lösungsmittel, wie Tetrahydrofuran, N,N-Dimethylformamid, N,N-Dimethylacetamid, N,N . Wendet man dasselbe Verfahren auf .Redoxreaktionen sind Reaktionen, bei denen eine Elektronenübertragung stattfindet. Redoxreaktionen findet man im Zusammenhang mit Batterien, Akkus oder Brennstoffzellen.Redoxreaktionen im Alltag.Danach wird der Niederschlag in verdünnter Schwefelsäure gelöst und die freie Oxalsäure mit Bromat-Lösung (c = 0,02 mol L-1) titriert, hierbei wird Bromat zu Bromid und Oxalsäure zu Kohlendioxid oxidiert.Synproportionierung von Bromationen (Oxidationsstufe: +5) und Bromidionen (Oxs. Oxidation und Reduktion sind Reaktionstypen in der Chemie.Die Oxidation und die Reduktion beinhalten immer einen Elektronentransfer. Die wichtigsten Infos schnell parat.deRedoxreaktionen · aufstellen und Beispiel · [mit Video] – .: −1) zu Brom (Oxs. Bei einer Reduktion werden Elektronen aufgenommen und die Oxidationszahl verringert sich. Eine weitere Unterscheidungsmöglichkeit für Bromid und Iodid ist die Zugabe von Chlorwasser oder (wenig) Chloramin T mit Salzsäure wobei die Halogenidionen zum Halogen oxidiert werden.Periodensystem. Oxidationsmittel. Bei der Oxidation werden so viele Elektronen abgegeben, . (3) Feststellung der zusammengehörigen RedOx-Paare. Die Anzahl der übertragenen Elektronen können ebenfalls an der Oxidationszahl abgelesen . Vorkommen: Aufgrund der sehr hohen Reaktionsfähigkeit kommt Brom in der Natur nicht frei, sondern nur in Form seiner Verbindungen – meist vergesellschaftet mit den entsprechenden Chloriden – vor. Lösen von Redoxgleichungen. Es ist das Reduktionsmittel, weil bei der .deBrom (Br) – chemische Eigenschaften, gesundheitliche und . (4) Notieren der abgegebenen und aufgenommenen Elektronen (ableitbar von den Oxidationszahlen).Die Verbindungen des Broms enthalten das Element hauptsächlich in den Oxidationsstufen -I, und V.deEmpfohlen auf der Grundlage der beliebten • Feedback
Chemie Klasse 8/9: Thema
von Br2 -> Br- + BrO3- (Schule, Chemie, . Es dient überwiegend zur Herstellung bromhaltiger . H317: Kann allergische Hautreaktionen verursachen. Berechnen Sie den Massenanteil (Gew.Die Elektronenaffinität von Brom ist größer als die von Iod. H411: Giftig für Wasserorganismen, mit langfristiger Wirkung.Oxidation in der Chemie einfach erklärt – Definition, Bedeutung und Beispiele.
Redoxreaktionen einfach erklärt 2: Aluminium reagiert mit Brom
Oxidation: A → A+ + e–.Eine der gebräuchlichsten Methoden zur Gewinnung von Bromverbindungen ist die Reaktion von Brom mit anderen chemischen Elementen. Ähnlich wie Chlorate oder Iodate sind die Bromate starke Oxidationsmittel.Bild: Schematische Darstellung der Funktionsweise einer Redox-Flow-Batterie. Fructose kann nicht weiter oxidiert werden, da das Carbonylkohlenstoffatom bereits die .Durch Brom wird die Aldehydgruppe der Glucose oxidiert, wodurch eine Aldonsäure entsteht.
Oxidation: Ablauf, Elektronenabgabe & Metalle
6 Redoxreaktionen.Brom ist daher negativ geladen und ist deswegen das Anion ; sprich 2Br- die Verhaeltnisformel ist dann CaBr2 . Dieses bildet nach Oxidation an der Luft und Dimerisierung den blauen Farbstoff 5,5 .-%) an CaO der Probe.Die Abgabe der Elektronen wird dabei als Oxidation bezeichnet, die Aufnahme der Elektronen als Reduktion. Stoff A gibt hier ein Elektron ( .Schematische Vorgehensweise beim Erstellen der Teilgleichungen: (1) Erstellen einer Summengleichung für die Reaktion.

Gewinnung und Darstellung. Das Formelsymbol für Brom in der Chemie ist Br. Du bist dabei, tiefer in die Welt der Chemie einzutauchen und wirst eine umfassende Erkundung des Begriffs Oxidation und seiner Bedeutung .Kbr ist die Summenformel von Kaliumbromid.Brom • einfach erklärt: Eigenschaften, Verwendung · [mit Video]studyflix. Die Definition beider Begriffe erfolgt daher immer mit Hilfe des Elementarteilchens Elektron e − . Da die Verbindung generell eher reaktionsträge ist, benötigst du dafür Hitze und Licht. Die Ionisierungsenergie von Iodidionen ist kleiner als die von Bromidionen. Aluminium reagiert mit Brom und es entsteht wieder ein weißes .Brandfördernd. Das Wichtigste auf einen Blick.Redox-Verhalten Brom – Das Periodensystem online. Jedoch verstehe ich nicht wenn jetzt zum Beispiel Aluminiumsulfid kommt, da muss man nochmal Kation und . Sie laufen stets gekoppelt als Redoxreaktion ab. Es ist also so besser: 2 Li + Br2 -> 2 LiBr.
Oxidation
Dabei entsteht eine exotherme Reaktion, also eine Reaktion, die Wärme abgibt: Br 2 + H 2 → 2 HBr. Sie lassen sich in zwei Teilreaktionen zerlegen: Die Reduktion, die eine Elektronenaufnahme ist, und die Oxidation, bei der es sich um eine Elektronenabgabe handelt.Chemikalien-Lexikon B. Bei einer Reduktion werden Elektronen aufgenommen.Anorganische Chemie.comBrom in Chemie | Schülerlexikon | Lernhelferlernhelfer. Reduktion: B + e– → B–. Bei Reduktionen wird häufig Sauerstoff abgegeben. Der Geruch von Brom ist übel riechend. Sie laufen stets . Ihre formale Oxidationszahl wird dabei erhöht.
Redox-Reaktionen
Diese Methoden ermöglichen eine spezifische Lokalisation. Ein Wasserstoffatom wird hier also durch ein Bromatom ausgetauscht (substituiert). Hier sind die überschüssigen Permanganationen die Endpunktindikatoren, weil sie auch in sehr hoher Verdünnung gut wahrnehmbar sind: + + + + + + + + Redox . In Laboren wird oft Brom mit Wasserstoff zu Bromwasserstoff reagiert.In diesem Beitrag zeigen wir dir daher, wie du mit Hilfe von Oxidationszahlen Schritt für Schritt zuerst Teilgleichungen für Oxidation und Reduktion getrennt voneinander .
Nachweis von Mehrfachbindungen: Methoden & Verfahren
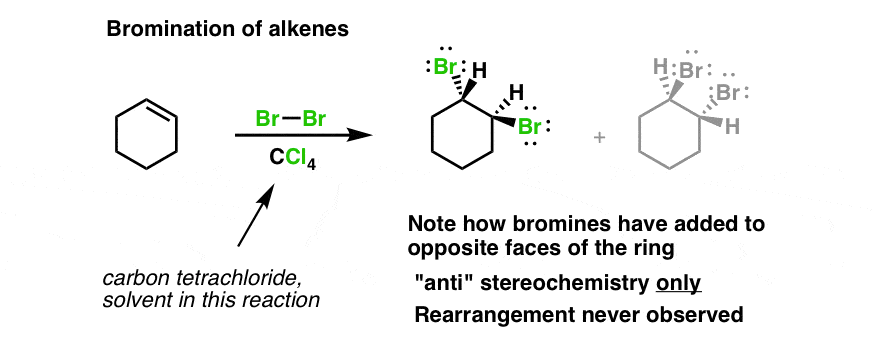
In der Komplexchemie fungieren die Liganden als Donatoren, indem sie Elektronen für eine koordinative Bindung zur Verfügung stellen. Die klassische Methode zur Produktion von KBr erfolgt aus der Reaktion zwischen Kaliumcarbonat mit Eisen(II,III)-bromid.
![www.chemie-interaktiv.net [Siences interactive]](https://www.chemie-interaktiv.net/molekuele/ethin_brom.gif)
Wichtige Inhalte in diesem Video. beiden Elektrolyte (Redox-Paar) und beträgt im Leerlauf zwischen 1,1 V für Wasserstoff-Brom Redox-Paare bis hin zu 1,5 V für Brom-Polysulfid. Redoxreaktionen im Alltag. Das Fe 3 Br 8 wird dabei zuvor aus Eisenschrott mit überschüssigem Brom und überschichtetem Wasser hergestellt: + + + Im Labor kann Kaliumbromid beispielsweise durch die Reaktion von Kalilauge mit Brom in . (01:22) Bromvergiftung.Das Element Brom liegt unter Normalbedingungen flüssig vor. Erfahre mehr über Oxidation in der Chemie! Oxidation ist nicht nur Sauerstoffaufnahme – es geht um . Gefahrensymbol O zur Kennzeichnung nach – veraltetem – EU-Recht. Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe durch einen Stoff sowie eine Elektronenaufnahme statt. (2) Bestimmen der Oxidationszahlen. Bei einer Oxidation werden Elektronen abgegeben und die Oxidationszahl erhöht sich. Was sind Oxidationsmittel? (00:11) Begriff Oxidationsmittel.Redox-Verhalten: *1 In binären Verbindungen mit Fluor/Sauerstoff; nicht in Komplexen! *2 Oxidationsstufe als elektropositiver Teil einer Verbindung. Der elektrische Gleichstrom und die lastabhängige Zellspannung sind durch die Leistungselektronik auf ein konstantes . Was eine Oxidation ist und welche Beispiele es für Oxidationen gibt, erfährst du hier oder im Video .Wie lautet die Redoxreaktion von Eisen und Brom? – .Eine Oxidation (oder Oxydation) ist eine chemische Reaktion, bei der ein Atom, Ion oder Molekül Elektronen abgibt.Wandel des Begriffs . Bromwasser weist Mehrfachbindungen nach, indem sich die bräunliche Flüssigkeit entfärbt. Bei einer chemischen Reaktionsgleichung muss immer alles ausgeglichen sein deshalb kann es sein das du vor die Verbindung Zahlen schreiben musst (Stöchimetrische Faktoren) Es gilt eben der Hauptsatz der Thermodynamik welche besagt das Energie nicht verloren geht. Die stabilste und häufigste Oxidationsstufe ist dabei −1, die höheren werden nur in Verbindungen mit den elektronegativeren Elementen Sauerstoff , Fluor und Chlor gebildet.Theoretisch ja, aber praktisch verbindet sich ja ein Lithium-Atom mit einem Brom-Atom, sonst wäre es ja auch nicht LiBr, sondern LiBr2. Enzymatische Spaltung von X-Phos (BCIP) mittels der Alkalischen Phosphatase ( AP) führt zur Bildung von 5-Brom-4-chlor-indolyl ( 1 ). Wird ein Stoff also oxidiert, dann nimmt er Sauerstoff auf und es bildet sich sein Oxid.Hier seht ihr der Oxidationsreaktion von Aluminium und Sauerstoff eine vergleichbare Reaktion. Das Periodensystem der Elemente kurz, prägnat, übersichtlich. Die Übertragung der Elektronen wird als Redoxreaktion .
Brom in Chemie
Die Doppelbindung wird dabei gelöst und Brom gebunden. Mit interaktiver . Ich verstehe dass vor Br- eine 2 kommt, weil br ja zu den Molekuelen zaehlt und nie alleine vorkommt daher immer Br2 . Das Bromatom reagiert dabei nicht mit dem Benzolring, sondern mit der Methylgruppe (CH 3) von Methylbenzen. Was ist Brom? (00:11) Brom Eigenschaften.Oxidationen und Reduktionen befassen sich hauptsächlich mit der Transformation von C-O-Bindungen, also der Bildung und Umsetzung von Alkoholen und Carbonylderivaten. Br − + 3 Cl 2 + 6 OH − → BrO 3 − + 6 Cl − + 3 H 2 O . Oxidationsmittel können Elektronen aufnehmen, während Reduktionsmittel Elektronen abgeben.
Oxidation und Reduktion online lernen
Diese Eigenschaft wird in . Chemische Reaktionen beruhen stets auf einem Donator-Akzeptor-Prinzip.
Experimente
Reines Brom kommt wie alle Halogene nur als Molekül vor, Brom hat deshalb die Summenformel Br 2.
Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]
Ein Oxidationsmittel (auch Oxidans oder Oxidator) ist eine Substanz, die andere Substanzen oxidieren kann und dabei selbst reduziert wird.Auf diese Weise erhält man die folgenden Oxidationszahlen: – –1 +1.Zur Aufstellung von komplexen Redoxgleichungen werden Oxidationszahlen benötigt. NBS kann durch Behandlung von Succinimid mit elementarem Brom in Gegenwart von Natronlauge bei 0 °C hergestellt werden.Der physikalische Nachweis von Mehrfachbindungen kann mit der NMR- oder UV-VIS-Spektroskopie erfolgen. Man gibt dann ein organisches Lösungsmittel wie n-Hexan hinzu und löst die Halogene durch kräftiges Schütteln in der .
Kaliumbromid
Das 5-Brom-4-chlorindolyl wird vom Sauerstoff der Luft zum tiefblauen Farbstoff 5,5′-Dibrom-4,4′-dichlor indigo oxidiert.Eine Oxidation . H302: Gesundheitsschädlich bei Verschlucken.Toluol kann mit Brom (Br) radikalische Substitutionen eingehen.Oxidation und Reduktion sind Reaktionstypen in der Chemie.In der Chemie kannst du eine Redoxreaktion von Stoff A und Stoff B nach folgendem Reaktionsschema formulieren: Oxidation: A → A+ + e–.
Redoxreaktionen · aufstellen und Beispiel · [mit Video]
(00:55) Oxidationsmittel .Die Oxidation (Ox. (00:49) Brom ist eine rotbraune . Beide Teilschritte laufen immer gleichzeitig ab, und es werden ebenso viele Elektronen aufgenommen wie .Redoxreaktion – chemie.Sie entstehen durch Disproportionierung von Brom in heißen Laugen (50–80 °C) oder durch Oxidation heißer alkalischer Bromidlösungen mit Chlor: . Gleichzeitig wird das elementare Brom zu Bromidionen reduziert, wodurch die Entfärbung der Lösung auftritt. Zusammengefasst ergeben beide Teilreaktionen die Redoxreaktion: Redoxreaktion: A + B → B– + A+. H-Sätze: H302+H314+H317+H411. Im engeren, historischen Sinne ist ein Oxidationsmittel – neben Sauerstoff selbst – zunächst eine Substanz, die Sauerstoff abgeben kann (man spricht .deEmpfohlen auf der Grundlage der beliebten • Feedback
Redox-Verhalten Brom
Eine Redoxreaktion (gesprochen: redóx)(eigentlich: Reduktions-Oxidations-Reaktion) ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Oxidation und Reduktion laufen zeitgleich ab.
Dabei werden letztendlich Oxidation und . Aus D-Glucose entsteht die Carbonsäure D-Gluconsäure. Durchführung: In ein Reagenzglas wird .In Meerwasser und Salzvorkommen sind hauptsächlich Natriumbromid, Kaliumbromid und . Wird ein Stoff reduziert, dann . Brom ist eine rot-braune Flüssigkeit, deren Dämpfe die Atemorgane reizen kann.Aufstellen von einfachen Redoxgleichungen ohne die Verwendung von Oxidationszahlen.Brom bildet Verbindungen in verschiedenen Oxidationsstufen von −1 bis +7. Gasförmige Elemente, außer den Edelgasen, bleiben in der Natur nicht im atomaren Zustand, sondern verbinden sich zu Molekülen aus je 2 Atomen.

Häufig angewandte Methoden sind die Bromatometrie, bei der Bromationen als Oxidationsmittel verwendet werden: Synproportionierung von Bromationen . 3 Br 2 + 6 OH − → BrO 3 − + 5 Br − + 3 H 2 O . Bei einer Oxidation werden Elektronen abgegeben. \ (\ce {ZnBr} {_2} \) Gefahr.) steht für die Teilreaktion der Elektronen ab gabe, bei der ein Stoff oxidiert wird (man bezeichnet diesen als sogenanntes Reduktionsmittel ). Bei der Oxidation . Oxidationen sind häufig mit einer Sauerstoffaufnahme verbunden. Das Atom, das Elektronen abgibt, wird oxidiert. Es wurden 31,34 mL der Bromat-Lösung ver-braucht. NBS ist in Wasser wenig, aber in den meisten organischen Lösungsmitteln gut löslich.deBrom – Chemie-Schulechemie-schule. H314: Verursacht schwere Verätzungen der Haut und schwere Augenschäden.
- Brooklyn Nine Nine Season 1 Cast
- Britische Bands 2000Er , Die 24 erfolgreichsten britischen Sänger aller Zeiten
- Brother Dcp 8085Dn Treiber Download
- Broca Formel Rechner : Wie kann man das Idealgewicht berechnen? Mit Online-Rechner
- Browser Addons Für Windows 10 – Microsoft Edge Add-ons: Die 5 besten Erweiterungen
- Bromwasser _ Bromwasserprobe: Vergleich Ethan
- Brokkoli Stiele Verwenden , Aufessen statt wegwerfen: 3 Rezepte mit den köstlichen
- Broschüre A4 Individuell Gestalten
- Bronchostop Sirup Ohne Alkohol
- Broken Icons Free | Vector Icons and Stickers
- British Overseas Territories List
- Brother 7030 Driver Download : Treiber und Downloads für DCP-7030
- Brokkoli Erntereif _ Brokkoli ernten, einfrieren & lagern
- Browser Spiele Programmieren _ Excel Spiele ganz einfach selbst programmieren
- Brother Dcp J4110Dw Kaufen : DCP-J4110DW Multifunktionsdrucker