Chrom Unterschied Oxidation | Redoxreaktion einfach erklärt • Oxidation, Reduktion
Di: Luke
Wird es auf höhere Temperaturen erhitzt, tritt Disproportionierung ein: 3 CrO → Cr + Cr 2 O 3.Die wichtigsten Oxidationsstufen des Chroms sind +VI und + III auch bekannt sind die Oxidationsstufen +V, +IV, + II . Oxidationszahlen können anhand der Valenzstrichformel (Lewis-Formel) oder anhand der Summenformel bestimmt werden. Chrom ist ein wichtiger Legierungsbestandteil für nichtrostende, hitzebeständige Stähle. in Chromlederabfällen durch Luftsauerstoff bei 40°C bis 50°C und einem pH-Wert über 7 innerhalb einiger Wochen zu Chrom(VI) fest.Dabei findet in vielen Fällen eine Verbrennungsreaktion statt und es wird Energie in Form von Wärme freigesetzt. Verbrennt man Magnesium an der Luft, so brennt dies mit einer grellen Lichterscheinung und großer Wärmeentwicklung. Das EU-Verbot für Chrom 6 verzögert sich zwar, aber Weitsicht zahlt sich immer aus.(01:06) Redoxreaktion Beispiel. Werkstoffe mit mittlerer Leitfähigkeit und hoher Festigkeit 25 5. Ionen des Chroms (oft in Verbindung mit Sauerstoff) weisen typische Farben auf (Chromat-Ion: gelb; Dichromat-Ion: orange; . In alkalischem Milieu liegt . Sie wird wegen ihrer starken Oxidationswirkung für die Reinigung von Glasgeräten . (01:55) Oxidationszahl.
Corey-Suggs-Oxidation
Ein geeigneter Komplexbildner sollte in der Lage sein, das gebildete Chrom(II) durch eine Komplexierung gegen die Oxidation zu stabilisieren . Da Sauerstoff molekular (2-atomig) vorkommt, wird pro .debiologie-schule.Rost ist somit ein wasserhaltiges Oxid des Eisens, eine chemische Verbindung, die zu den Oxiden gehört und zusätzlich Wasser und Hydroxidionen enthält (Oxidhydrat). Das Chrom(II)ion ist in wässriger Lösung jedoch nicht stabil und wird leicht zu Chrom(III) oxidiert. Aufstellen von komplexen Redoxgleichungen mit Oxidationszahlen.

Unterschied zwischen Oxidation und Verbrennung / Chemie

Es hat damit eine anomale Konfiguration, was durch die besondere Stabilität des halbbesetzten d .Chrom ist ein silberglänzendes zähes Schwermetall der 6. Ein glänzender Wasserhahn macht jedes Badezimmer und jede Küche zur Augenweide. (02:42) Eine Redoxreaktion ist eine sehr wichtige chemische Reaktion.Chrom 3 Verfahren.3 Kupfer-Chrom 19 4.Chrom(III)-Verfahren unterscheiden sich jedoch grundlegend von den klassischen Chrom(VI)-Verfahren.1 Kupfer-Beryllium 25 5.Im Wesentlichen handelt es sich um Elektroden, die so zusammengesetzt sind, dass sie ein bestimmtes erforderliches Oxidationspotenzial aufweisen, um die . Die Bezeichnung Chrom 3 steht für dreiwertiges Chrom.
Passivierung
Hierfür wird alkalische Chromatlösung mit Eisessig sauer gemacht (pH 3-5) und mit Natriumactetat gepuffert. ⃕ Fluor ist das stärkste Oxidationsmittel, somit das schwächste Reduktionsmittel. Primäre Alkohole werden mit Chromsäure zunächst zum Aldehyd, in einem zweiten Schritt bis zur .Oxidationszahlen sind eine wichtige Hilfsgröße bei Redox-Reaktionen.Die Reduktion von Chrom ist ein mehrstufiger Prozess, der über die Zwischenstufe Chrom(II) abläuft. Die gelösten Metallionen des Grundwerkstoffs werden in die Chromatschicht eingebaut.

B Schwefel + Sauerstoff -> Schwefeloxid) Die Stoffe die bei . Die Oxidationen von primären und sekundären Alkoholen liefern verschiedene Produkte. Chrom (VI)-oxid bildet rotviolette, geruchlose, nadelförmige Kristalle. Überwiegend handelt es sich dabei um .
Chromatieren
Bei der Oxidation eines primären Alkohols bildet sich ein Aldehyd, während sekundäre .Seine Giftigkeit (Toxizität) hängt vom Oxidationszustand ab. Aus der elektrochemischen Spannungsreihe lässt sich das Redoxverhalten eines Stoffes .deEmpfohlen auf der Grundlage der beliebten • Feedback
Chrom in Chemie
Oxidation verstehen
Sie entsteht durch die Oxidation des Eisens, ohne dass höhere Temperaturen erforderlich wären. Beide werden für unterschiedliche Zwecke verwendet, wobei Chrom hauptsächlich zum Beschichten und Herstellen von Legierungen verwendet wird, . Diplom-Physiker Andreas Stierle und Prof.4Kupfer-Nickel-Zinn 29 6.6Kupfer-Zinn 24 5.
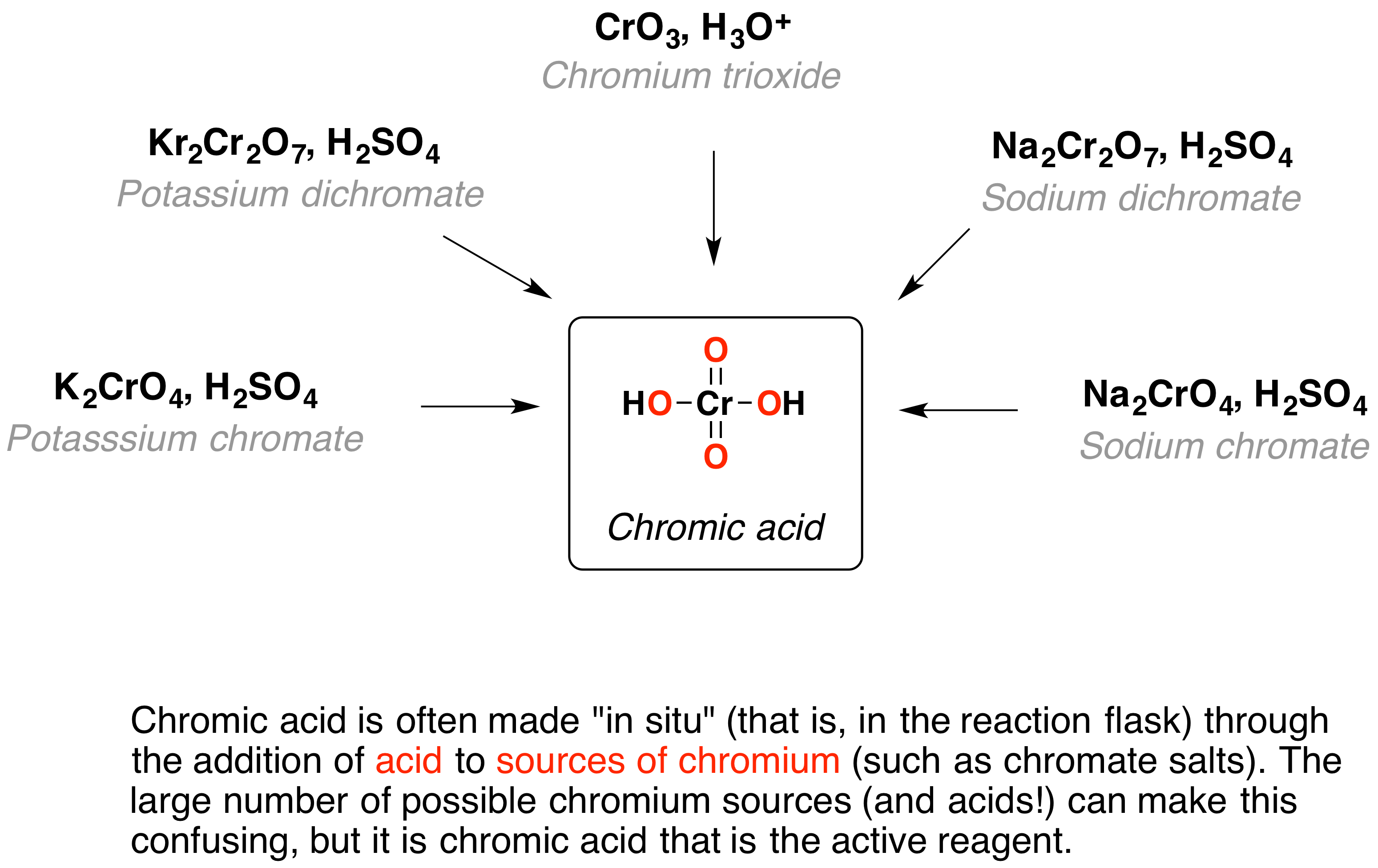
Chemische Eigenschaften: Chrom ist an der Luft und auch gegen Feuchtigkeit sehr beständig. Allerdings können sich auch andere Stoffe mit Sauerstoff verbinden, da redet man dann auch von einer Oxidation. Suggs ist eine Namensreaktion aus der organischen Chemie und wurde erstmals 1975 veröffentlicht.als Oxidation bezeichnet man die chemische Reaktion, wenn sich ein Stoff mit Sauerstoff verbindet.Chromatieren bezeichnet eine Gruppe von Verfahren der Oberflächentechnik. Oxidation verstehen – Grundlagenforschung mit Molekularstrahlepitaxie. Chrom (II)-oxid besitzt eine Natriumchlorid -Struktur und disproportioniert bei höheren Temperaturen in Chrom und Chrom (III)-oxid. Man unterscheidet die Formen der . Verbrennung Oxidations-Reduktionsreaktionen sind eine grundlegende Art chemischer Reaktionen, auf die wir im Leben häufig stoßen.

Dort verbindet sich Sauerstoff mit einem anderen Molekül, um ein Oxid herzustellen.Bei Alkoholen unterscheidest du zwischen primären, sekundären und tertiären Alkoholen. Zur Aufstellung von komplexen Redoxgleichungen werden . Doch nach jahrelangem Gebrauch zeigt sich oft ein unschöner Effekt: Die Chromschicht ist matt, zerkratzt oder abgeblättert. So sind die Schichten deutlich dünner und müssen, um die erforderlichen Korrosionseigenschaften zu erfüllen, immer auf einer mikroporigen Nickelschicht abgeschieden und anschließend passiviert werden.
Redoxreaktion einfach erklärt • Oxidation, Reduktion
Farbstoffen, die in gelöster Form – auch als kolloidale Lösungen – angewandt werden, und. Was ist Chrome? Wie oben erwähnt, bezieht sich Chrom auf . Die wohl wichtigste Eigenschaft von Chrom 3 ist die deutlich bessere Umweltverträglichkeit. Enthält die Schutzschicht Chrom, spricht man vom Chromatieren. Humpert bietet bereits seit 2017 die REACH-konforme Chrom 3 Beschichtung als Alternative zur bisherigen Chrom 6 Oberflächenveredelung.Chemie von Chrom: Chrom hat die Elektronenkonfiguration [Ar]4s 1 3d 5.Periodensystem: Chrom (Steckbrief) – Biologie-Schule.2 Kupfer-Kobalt-Beryllium / Kupfer-Nickel-Beryllium 26 5.
Chemische Eigenschaften und Verwendung von Chrom
Der Grundwerkstoff verarmt so im Laufe der Zeit an Chrom, sodass dessen Konzentration unter ein kritisches Level fallen kann und es zu innerer Oxidation sowie im weiteren Verlauf zu Materialversagen . Bei Mäusen treten nach intraperitonealer Gabe im Knochenmark Mikro .
Praktikum Anorganische Chemie/ Chrom
Kaliumdichromat bildet leuchtend orangerote Kristalle ohne Kristallwasser, die einen Schmelzpunkt von 397 °C haben und sich ab 500 °C unter Sauerstoff abgabe zu Kaliumchromat K 2 CrO 4 und Chrom (III)-oxid Cr 2 O 3 zersetzen.
Elektrochemische Spannungsreihe
Mit Bariumsalzen entsteht ein gelbes Bariumchromat.Dabei unterscheidet man, die schnelle Oxidation, die auch Verbrennung genannt wird und die->langsame (stille) Oxidation, die man auch Korrosion, Rosten oder Verwittern nennt.Theoretische Grundlagen Oxidation von Alkoholen mit Chromsäure.Bei der elektrolytischen Verchromung dagegen wird das Chromtrioxid in einem elektrolytischen Prozess in mehreren Schritten reduziert und auf die Ware als . Im Gegensatz dazu sind tertiäre Alkohole nicht für die Oxidation geeignet.
Chrom(III) — Eine echte Alternative zu Chrom(VI)?
Oxidation Ursprünglich wurden Oxidationsreaktionen als Reaktionen identifiziert, an denen Sauerstoffgas beteiligt ist. Den Stoff, der bei der Reaktion von einem Metall bzw.Grundsätzlich ist zu unterscheiden zwischen.Chrom (VI)-Verbindungen sind chemische Verbindungen, die das Element Chrom in seiner höchsten Oxidationsstufe +6 enthalten. Es bildet zahlreiche farbige Verbindungen, hauptsächlich mit den Oxidationsstufen II, himmelblaue [Cr(H2O)6]2 + – Ionen, III, violette [Cr(H2O)6]3 + – Ionen, und VI, gelbe CrO4 2 – – Ionen.4 Kupfer-Chrom-Zirkon 20 4.Im Vergleich zu Edelstahl und anderen Metallen wie Eisen hat Chrom ein maximales Oxidationspotential, während eine äußere Chromschicht den Edelstahl vor Oxidation schützt.5Kupfer-Nickel-Phosphor 22 4. Für die Anlagentechnik .Dadurch muss das Chromoxid aus dem metallischen vorliegenden Chrom des Grundwerkstoffs immer wieder nachgebildet werden. Rost ähnelt somit der Verbindung Braunstein (wasserhaltiges Mangandioxid .Reduktionswirkung.Elektrochemische Korrosion ist die von der Oberfläche ausgehende Zerstörung eines metallischen Werkstoffs aufgrund von Redoxreaktionen des Metalls mit seiner Umgebung.Chrom(VI)-Verbindungen sind in zahlreichen Studien mit Bakterien und Säugerzellen genotoxisch.Oxidation von Chrom(III) z.3 Kupfer-Nickel-Silizium 27 5.Chrom 3 ist unter verschiedenen Benennungen bekannt.Verteilung und Wirkung von Cr (VI) am Beispiel unterschiedlich belasteter Böden.Liegen die Orte der Oxidation und der Reduktion in direkter Nachbarschaft zueinander, spricht man von einem Lokalelement. Das Metall Chrom tritt in Böden vorwiegend in zwei Formen auf: als Kationisches, meist wenig lösliches und relativ untoxisches chrom (III) sowie als lösliches und toxikologisch relevantes Chrom (VI) in Form des Chromat-Anions. Anschließend kann mit .Mit Sauerstoff (Verbrennung) bildet Chrom nach Entzündung verschiedene Oxide.Passivierung bezeichnet in der Oberflächentechnik die spontane Entstehung oder gezielte Erzeugung einer nichtmetallischen Schutzschicht auf einem metallischen Werkstoff, um die Sauerstoffkorrosion des Grundwerkstoffes zu verhindern oder stark zu verlangsamen.Übersicht
Chrom(VI)-oxid
Oxydation in alkalischer Lösung. Erläuterungen: a) Je größer E° red um so leichter erfolgt die Reduktion: F2(g) + 2 e – ⇄ 2 F-(aq) E° red = 2,87 V ⃕ Halbreaktion mit dem größten Elektrodenpotential, F2 ist leicht zu reduzieren.Durch Oxidation von Alkoholen können Aldehyde, Ketone und Carbonsäuren entstehen. Wenn sich die Oxidationszahlen von zwei verschiedenen Atomen verändern, handelt es sich um eine Redox-Reaktion. Dabei wurden drei Gruppen potenzieller Alternativen in der engeren Wahl mit drei .
Chrom(VI)-Verbindungen
Umgangssprachlich wird es oft nur Chromoxid genannt.
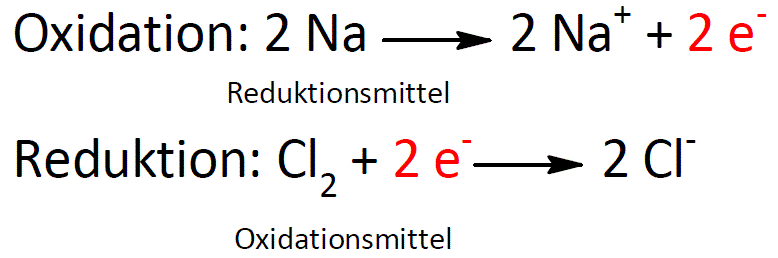
Metallisches Chrom
Das Element Chrom
Die elektrochemische Spannungsreihe ist eine Auflistung von Redox-Paaren nach ihrem Standardelektrodenpotential ( Redoxpotential unter Standardbedingungen gegen die Standard-Wasserstoffelektrode ). Kaliumdichromat ist ein starkes Oxidationsmittel, besonders in saurer Lösung. Die höhere Temperatur .Dabei werden auf metallischen Oberflächen durch die Einwirkung von Chromsäure komplexe Chromsäuresalze gebildet.Bei diesem Vorgang wird der Grundwerkstoff angelöst. Vor allem bei Metallen wird sie auch Redoxreihe genannt. Die Verbindung ist als brandfördernder Gefahrstoff eingestuft. Das Wichtigste auf einen Blick.Isolierte tetraedrische CrO 4 -Einheiten enthalten auch schwarze oder blauschwarze Oxochromate (V), M 3 [CrO 4 ], sowie blauschwarze Oxochromate (IV), M 4 [CrO 4 ]. Werkstoffe ohne besondere Anforderung . Chromate und Dichromate [Cr (VI)] sind etwa 100-mal giftiger als die Cr (III)-Verbindungen.Auch bei den Vorproben tritt beim Schmelzen der Salzperle mit Phosphorsalz oder Borax eine charakteristisch grüne Färbung mit Chrom (III)-Ionen auf. Erst bei stärkerer Erhitzung entstehen Anlauffarben. Kurz gesagt, Rost ist eine Form von .Die Corey-Suggs-Oxidation (auch PCC-Oxidation), benannt nach ihren Entdeckern E.
Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]
Der Antrag beschreibt drei unterschiedliche technische Leistungsanforderungen. (03:57) Redoxreaktion: Redox-Begriff.
Chrom(III) und Chrom-Sex (VI)
In viel Wasser löst es sich unter Bildung von gelber .Der Hauptunterschied zwischen Korrosion und Oxidation besteht darin, dass Korrosion ein umfassenderer Prozess ist, der sich auf die allgemeine Zersetzung von Metallen bezieht, während Oxidation ein spezifischer Korrosionsprozess ist, der auftritt, wenn Metalle Sauerstoff ausgesetzt werden. Einige Versuche zeigten keine Oxidation von Chrom(III) in verschiedenen humusreichen Böden, auch . Rost ist eine solche Reaktion zwischen Eisen und Sauerstoff. CrO entsteht bei der thermischen Zersetzung von Chromhexacarbonyl bei 200 bis 250 °C im Vakuum. Die Reaktion beschreibt die Oxidation eines primären Alkohols RCH 2 OH zu einem Aldehyd.Chromschwefelsäure ist eine bräunliche, dickflüssige Flüssigkeit mit der Formel H 2 SO 4 / CrO 3, die hauptsächlich aus konzentrierter Schwefelsäure und etwa 5 % Chromtrioxid (Chrom(VI)-oxid) besteht. Chrom (II)-oxid, Chrommonoxid, CrO, schwarze, im Steinsalzgitter kristallisierende Verbindung. Ein sehr gebräuchliches Trennverfahren ist die überführung des Chroms in die 6wertige Oxydationsstufe und Abscheidung der . In Chromlederabfällen können bis zu 100 mg/kg Chrom(VI) vorkommen. Dafür können verschiedene Dinge verantwortlich sein, etwa: Gewalteinwirkung durch .Der Hauptunterschied zwischen Chrom und Edelstahl besteht darin, dass Chrom ein höheres Oxidationspotential aufweist, während Edelstahl vor Oxidation geschützt ist. Führen Sie folgende Versuche durch, um die Oxidierbarkeit von primären, sekundären und tertiären Alkoholen zu unterscheiden: Stellen Sie eine basische Kaliumpermanganat-Lösung her, indem Sie zu 4 mL Kaliumpermanganat-Lösung (c≈ 0,01 ? ?) 8 mL .
Chrom Vorkommen
5 Einzelnachweise.Pflege & Reparatur der Chromschicht.deChrom in Chemie | Schülerlexikon | Lernhelferlernhelfer. Chrom(VI)-verbindungen sind toxisch, krebserregend . Nichtmetall mit Sauerstoff entsteht, nennen wir Oxid.Als Oxidationsmittel wird das Corey-Reagenz, besser .
- Chuck E Cheese Pizza Scam , Chuck E Cheese Pizza is A Scam??
- Chromecast Audio Splitter – How to separate audio and video in Chromecast
- Christliche Club Mitglied Werden
- Christliche Schule Gera Login , Neubau für Christliche Schule in Gera gestartet
- Churrascaria O Frango Hamburg : Churrascaria O Frango, Hamburg
- Christoph Herbst Hörbücher | Christoph Maria Herbst Humor online kaufen
- Chyna Height : Chyna Bio Information
- Christian Dior Collection Privee
- Chrysler Building Baujahr 1930
- Chromecast Wiederherstellen | So funktioniert Streaming mit Chromecast
- Christ Portalwaschanlage – Hersteller für Autowaschanlagen
- Christliche Vorstellung Vom Himmel
- Churros Mit Schokolade Frittieren
- Что Такое Алкоголизм – Что такое алкоголизм? Это заболевание или нет?
- Christmas Tree Removal Services