Estados De Oxidación Elementos
Di: Luke
• El estado de oxidación del hidrógeno es (+1), excepto en hidruros metálicos (-1) • En una especie neutra la suma de los estados de oxidación de sus elementos es cero (0) + + ? 2 + ? − − ? 4 = 0 • El estado de oxidación de un ión constituido por un solo átomo (iones monoatómicos) es igual a su carga.El estado de oxidación de un elemento no combinado es cero. La tabla está basada en una realizada por Greenwood and Earnhshaw con notas añadidas. El número de oxidación del flúor es -1 en todos sus compuestos.El estado de oxidación cero corresponde muchas veces a los elementos en su estado fundamental. Entre los lantánidos, se encuentran excepciones al patrón 4f n 5d 0 6s 2 en tres casos.Elementos Químicos: Estados de oxidación.El estado de oxidación de un átomo en un compuesto químico se determina por la cantidad de electrones que gana o pierde durante una reacción. De todos los elementos químicos conocidos, los gases nobles son los más estables y ello es debido a que tienen 8 electrones en la última capa (excepto el He que tiene 2). Propiedades: Estados de oxidación.Óxido de mercurio (II): Se coloca primero el elemento mercurio que es el catión y luego el anión que es el oxígeno. Tenemos que observar la electronegatividad de los átomos que componen la molécula.

1) ¿Cuál es el estado de oxidación del Al? a) +1 b) +2 c) +3 2) ¿Cuál es el estado de oxidación del F? a) -1 b) +1 3) ¿Cuál es el estado de oxidación del Ne?

La tabla está basada en una realizada por Greenwood and Earnhshaw con .En esta ecuación tanto H 2 como O 2 son elementos libres; siguiendo Regla # 1 , sus estados de oxidación son 0. Por ejemplo, el ión óxido O(2-) tiene estado de oxidación -2, pero en cambio la molécula diatómica de oxígeno neutra .Dateigröße: 19KB
Estado de oxidación
Reacciones redox y electroquímica >.O +1 (regla 6). La estructura molecular estable del SO3 se sustenta en la compartición de electrones entre el átomo de azufre y .
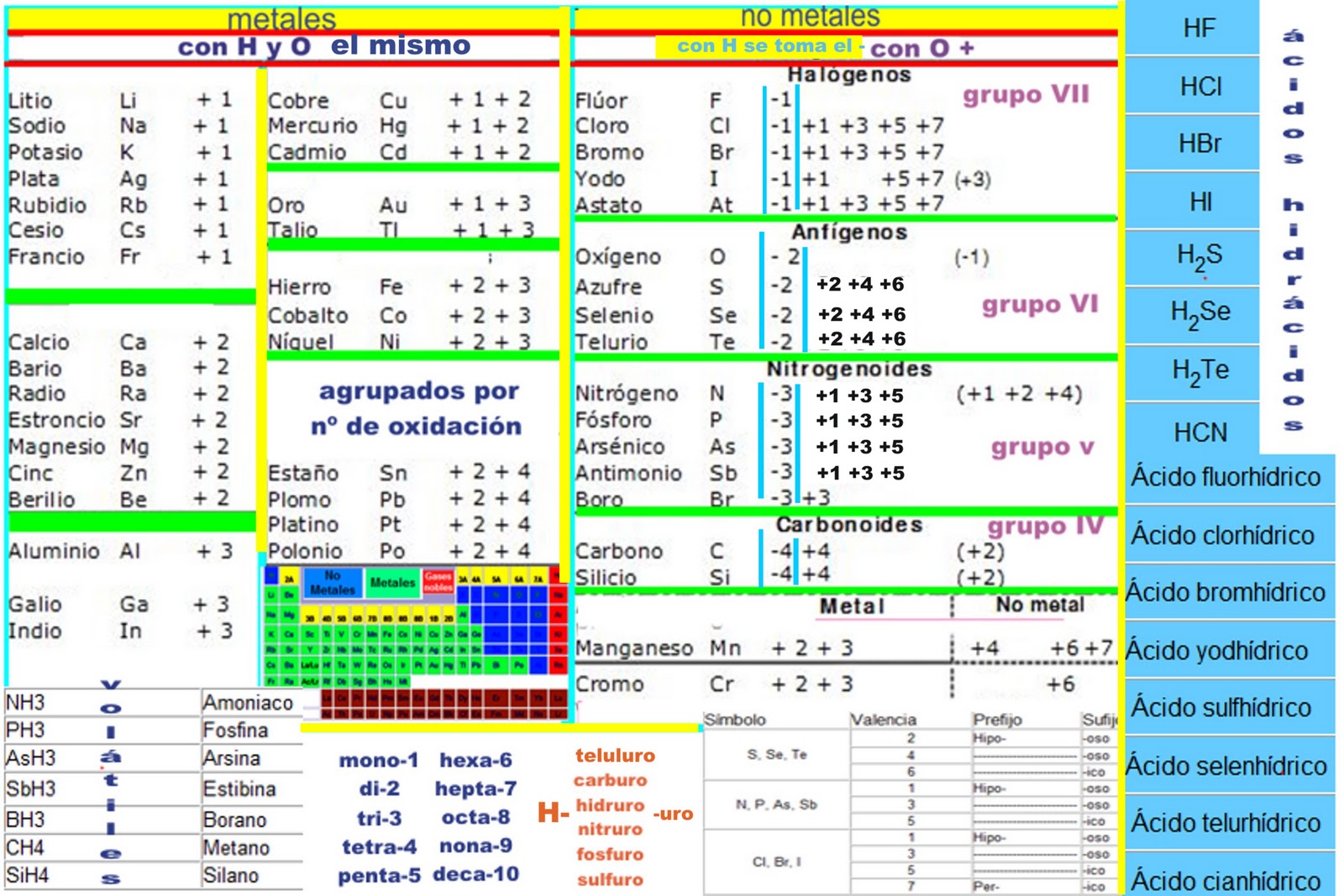
El estado de oxidación de un elemento o molécula neutra es 0.En el estado elemental o no combinado, los átomos tienen un estado de oxidación de cero. NÚMEROS DE OXIDACIÓN DE LOS ELEMENTOS DE LA TABLA P ERIÓDICA. Por lo tanto, el estado de oxidación de H en H 2 O debe ser +1. Esa es una lista de los elementos químicos, excluyendo aquellos valores no enteros.

Figura \(\PageIndex{1}\): Los no metales exhiben estos estados de oxidación comunes en compuestos iónicos y .¿Qué Es El Estado de Oxidación?
Estado de Oxidación
Prueba de Estados de oxidación para 2nd grade estudiantes. En un compuesto iónico el .Las principales reglas para conocer el estado de oxidación (E. El lantano está fuera de esta generalización, pero se incluye en la tabla por su trivalencia uniforme y otras similitudes. En química, el estado de oxidación (EO) es un indicador del grado de oxidación de un átomo que forma parte de un compuesto u otra especie química (por ejemplo un ión ).También pueden ser positivos o negativos y tener un valor de cero.Reglas DE LOS Estados DE Oxidación.Tabla periódica con números de oxidación.El mayor EO conocido es +8 para los tetraóxidos de rutenio, xenón, osmio, iridio, hassio y algunos compuestos complejos de plutonio, mientras que el menor EO conocido es -4 .Recuerde que un elemento exhibe un estado de oxidación positivo cuando se combina con un elemento más electronegativo y que exhibe un estado de oxidación negativo cuando se combina con un elemento menos electronegativo. Luego se intercambian los estados de oxidación.El estado de oxidación se representa por números que pueden ser positivos, negativos o cero. La hemoglobina solo transportará el oxígeno si el hierro está en el estado de oxidación de 2+; la oxidación del hierro a Fe 3+ evita el transporte del oxígeno. Estos representan la pérdida o ganancia de electrones .Reglas para asignación números de oxidación.
Número de oxidación (estado de oxidación)
El mayor estado de oxidación conocido es +8 para los tetraóxidos de rutenio, xenón, osmio, iridio, hassio y algunos compuestos complejos de plutonio, mientras que el menor estado de oxidación conocido es -4 para algunos elementos del grupo del carbono . Formalmente, es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces con elementos distintos fueran 100% .ELEMENTOCEROHidrógenoHHelioHeLitioLiBerilioBeAlle 110 Zeilen auf es. Entender la función de los electrones y las cargas eléctricas en los elementos .110 ZeilenEstados de oxidación de los elementos. El oxígeno en sus compuetos presenta E. De acuerdo con Regla # 6 , el estado de oxidación del oxígeno suele ser -2. El estado de oxidación del Oxígeno es igual a -2.Los estados más comunes aparecen en negrita. Cuando la hemoglobina pierde su oxígeno, el color cambia a un rojo azulado. El número de oxidación del oxígeno combinado es −2, ya que acepta hasta 2 electrones.De Wikipedia, la enciclopedia encyclopedia. El producto es H 2 O, que tiene un estado de oxidación total de 0.Los estados de oxidación más comunes en la tabla de estados de oxidación son +1, +2, +3, -1 y -2. En elementos individuales su valor es cero, porque no ha sido reducido ni oxidado. En un compuesto neutro; la suma de los estados de oxidación es cero.1) El número de oxidación del azufre en el SO es . Remarcar la importancia de los estados de oxidación en la química. Los estados más comunes aparecen en negrita. El mayor estado de oxidación conocido es +8 para los tetroxidos de rutenio, . ¡Encuentra otros cuestionarios por Chemistry y más en Quizizz gratis! Prueba de Estados de oxidación para 2nd grade estudiantes.
¿Qué es el número de oxidación?
La información sobre los estados de oxidación ayuda a determinar el número de átomos y, por lo tanto, la estructura molecular y las propiedades . Los sistemas tienden a alcanzar el estado más estable posible minimizando su energía. En ella se observa que: – Los elementos metálicos sólo tienen estados de oxidación positivos, mientras que los no metálicos pueden tener números de oxidación positivos o negativos.Cómo asignar estado de oxidación al Dioxígeno.Geschätzte Lesezeit: 50 Sekunden
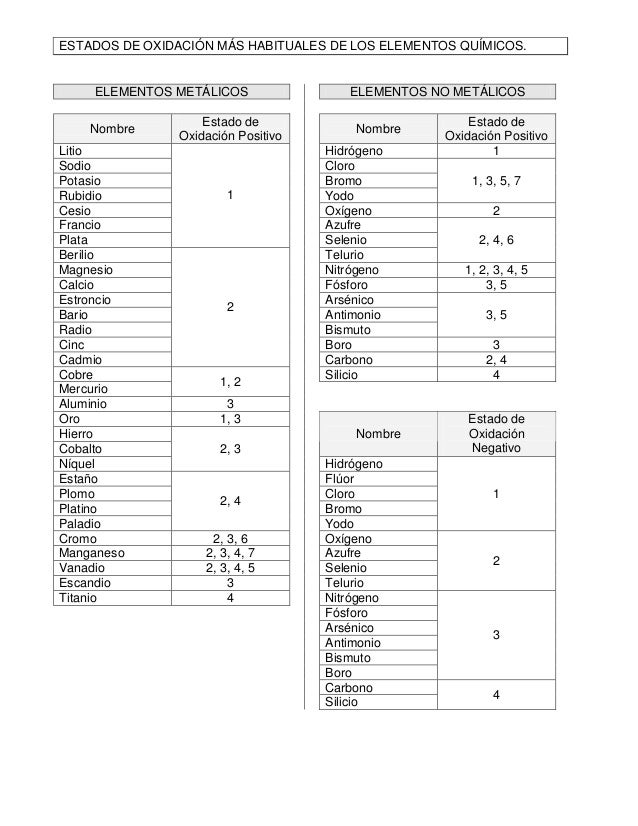
Tabla periódica con números de oxidación
Los elementos tienden a estabilizarse . Química avanzada (AP Chemistry) >. Además, muchos de estos elementos son metales de transición, lo que .El estado de oxidación de un elemento se define como la carga formal en el átomo si se asume que todos los enlaces son completamente iónicos.Los elementos de transición son elementos químicos que se caracterizan por tener electrones en los orbitales d y f, lo que les confiere propiedades únicas como su capacidad para formar compuestos complejos y su tendencia a exhibir múltiples estados de oxidación.O -2 (regla 7), mientra que el hidrógeno tiene E. Esto es, exceptuando en los alcalinos los compuestos con flúor, los peróxidos, en los que su número de oxidación es igual a -1; el número de . Los óxidos de estos últimos metales se pueden formar usando otros reactivos, pero se descomponen .Estados de oxidación – Concurso de preguntas.org anzeigen
Estados de oxidación de los elementos
Debido a que la estabilidad del estado de oxidación más alto disminuye con el aumento del número atómico, el ácido telúrico es un oxidante más fuerte que el ácido . 2) El número de oxidación del cloro en el óxido de cloro (I) (Cl2O) es. Los seres humanos interactúan el uno con el otro de varias formas complejas, y clasificamos estas interacciones de acuerdo con patrones de comportamiento comunes.Propiedades: Estados de oxidación. ¡Encuentra otros cuestionarios por Chemistry y más en Quizizz gratis! Skip to Content. Ejemplo: Ca+2 . En la molécula de dioxígeno tenemos un caso especial, ambos átomos son idénticos y poseen también idéntica electronegatividad. Algunos elementos casi siempre tienen los mismos estados de oxidación en sus compuestos: Elemento: Estado de oxidación habitual: Excepciones: Metales del grupo 1: Siempre +1 : Metales del grupo .Los estados de oxidación , (también conocidos como números de oxidación), son números que muestran cuántos electrones perdería o ganaría el .Estos elementos reaccionan con los halógenos para formar una variedad de haluros que varían en estado de oxidación desde 1+ a 6+.O = 0) La suma de los estados de oxidación de los átomos .
Anexo:Estados de oxidación de los elementos
Calcule los estados de oxidación de elementos en compuestos.
El estado de oxidación de todos los elementos en su estado libre es 0.I 2 + 2e – 2I – Cuando se escriben reacciones químicas, las siguientes reglas permiten obtener el estado de oxidación que presenta cada elemento: Entre átomos distintos que . En compuestos, el estado de oxidación del flúor es siempre -1.

) de los elementos en un compuesto químico son: Los elementos simples en estado libre, sin combinar (Na, Cu, . Todo el tiempo se producen reacciones redox a nuestro alrededor: en la quema de combustibles, la corrosión de metales e .Una reacción de oxidación–reducción, o reacción redox, es una reacción en la que hay una transferencia de electrones entre especies químicas (los átomos, los iones o las moléculas que intervienen en la reacción).Los estados de oxidación de los elementos de un ion poliatómico es igual a la carga presentada por el ion cuando se da una suma de sus estados. Los halógenos cuando están unidos con un metal, tienen estado de oxidación –2. Cuando dos humanos intercambian información, decimos que están comunicando.El número de oxidación o estado de oxidación indica el número de electrones que un átomo gana o pierde al unirse a otro .
¿Cómo asignar estados o números de oxidación en moléculas?
-Los elementos puros tienen número de oxidación de 0: Fe0, P40, S80.El estado de oxidación de un elemento se determina mediante la tabla de estados de oxidación, la cual proporciona una referencia precisa para cada elemento . Esto se debe a que el elemento no ha perdido ni ganado electrones y, por tanto, es neutro. Al calentarse, el oxígeno reacciona con todos los elementos de transición excepto el paladio, platino, plata y oro. -El átomo de hidrógeno, dependiendo de con quién esté enlazado, tiene número de . Este alto grado de oxidación sugiere una elevada reactividad con otros elementos. – El número de oxidación más elevado que puede tener un elemento de los HClO 4, la suma de los estados de oxidación de los elementos que lo componen es 0 (regla 1).Los estados de oxidación de los elementos se muestran en la siguiente figura (Fig.Esa es una lista de los elementos químicos, excluyendo aquellos valores no enteros.Tendencias del estado de oxidación en la tabla periódica (video) | Khan Academy. El estado de oxidación 0, que ocurre .Como se esperaba para los compuestos que contienen elementos en su estado de oxidación más alto accesible (+6 en este caso), los ácidos sulfúrico, selénico y telúrico son oxidantes. Vamos con el O₂, dioxígeno y dibujamos la molécula en dos dimensiones.O = 0); N 2 (E. Un elemento menos electronegativo tendrá un . El número de oxidación de un elemento en un ion monoatómico es igual a la carga de ese ion.Información general Fundamentos de Química (CNIC040) 999+Documentos. Número de oxidación de los elementos más .El estado de oxidción del grupo IIA, zinc y cad-mio, es +2.El estado de oxidación tiene ciertas características que varían de acuerdo a la sustancia o átomo que se este manejando.La molécula de SO3 es un compuesto covalente que presenta un átomo de azufre con un estado de oxidación de +6 y una carga formal de 0.Las moléculas de oxígeno transportan la hemoglobina en la sangre cuando se unen al centro del hierro.La configuración electrónica del estado fundamental de los elementos lantánidos es generalmente del tipo (Xe) 4f n 6s 2 . Esto se aplica independientemente de la estructura del elemento: Xe, . La carga de un ion estará determinada por la suma total de las cargas de todos sus átomos. El número de oxidación del aluminio combinado es siempre +3, ya que cede tres electrones. Los estudiantes compartieron 1314 documentos .Comprensión del concepto de estado de oxidación. Todos los elementos en estado natural o no combinados tienen número de oxidación igual a cero. El estado de oxidación 0, que ocurre para todos los elementos, viene implícito en la columna con el símbolo de cada elemento.El número de oxidación de ambos elementos sin combinar es 0 (cero), ya que están equilibrados eléctricamente. El oxígeno es -2 y el mercurio está trabajando con el estado de oxidación +2 como se aprecia dentro del paréntesis, quedando: Hg2O2 simplificando queda: HgO . En un radical, la suma de los estado de oxidación es la carga radical.
- Essensverbot Am Arbeitsplatz Mitbestimmung
- Essensrationen Beispiele _ die Essensrationen
- Etwa Befangenheitsantrag Richter
- Etiketten Selbst Gestalten Und Drucken
- Ethercat Zykluszeit , EtherCAT
- Ethische Verpflichtungen Organtransplantation
- Essigsaure Tonerde Salbe Apotheke
- Estradiol Fem Anwendung , Estriol 2 mg fem JENAPHARM® Tablette
- Essen Wahrzeichen – DIE TOP 10 Wahrzeichen in Paris (2024)
- Eu Kraftstoffverbrauch 2024 | Novelle der Pkw-Energieverbrauchs- kennzeichnungs-Verordnung
- Essplatz In Kleinem Wohnzimmer