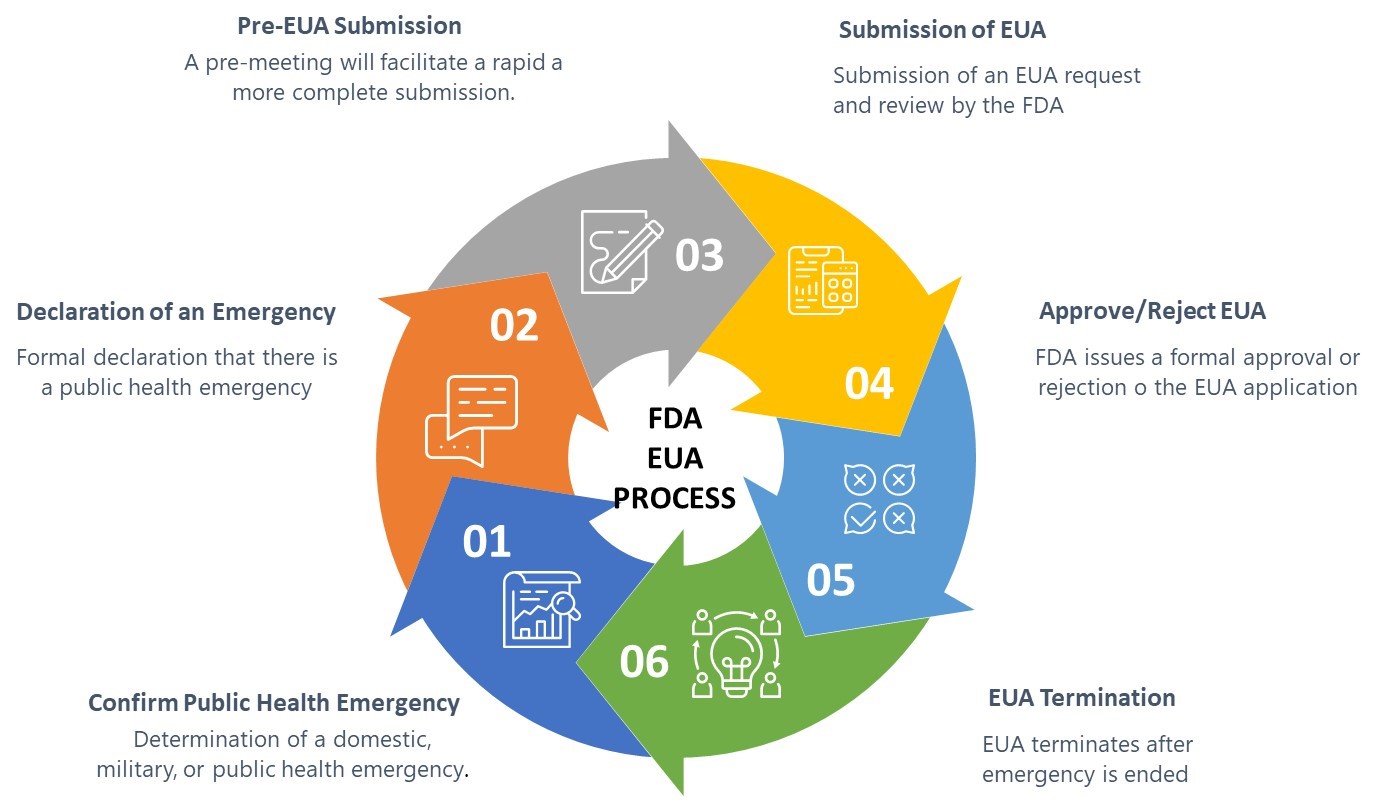
Fda Prozessvalidierung | Process Validation: General Principles and Practices
Di: Luke
Im Falle von Großprojekten kann es sinnvoll sein, separate VMPs zu erstellen.
Die neuen EU-/FDA-Ansätze zur Prozessvalidierung
Bei der Erstellung des VMPs kann auf vorhandene Dokumente Bezug genommen werden. FDA hat im Steuerjahr 2020 18,5 % ihrer 483er ausgestellt, die gegen die Anforderungen von 21 CFR 820.
Sie zeigt, das „current thinking“ der FDA, das Thema Prozessvalidierung betreffend.75, die Anforderungen an die . Unser GxP-Services-Team übernimmt je nach Ihrem Bedarf einzelne Prüfungen . Steuern: 57,80 € inkl. Die begleitende Validierung sollte selten genutzt werden, kann aber möglich sein, wenn z. Die vorliegende Neuauflage erläutert und kommentiert detailliert die Änderungen im revidierten Annex 15 .Die FDA beschreibt in den Quality System Regulations, konkret im 21 CFR 820. Man könnte Usability Validierung mit Prüfung der Gebrauchstauglichkeit übersetzen.2 Abschnitt 5 sollte zusammen mit der aktuellen EMA-Leitlinie zur Prozessvalidierung Anwendung finden.Über den Freedom of Information Act ist die US FDA verpflichtet, Inspektionsergebnisse zu veröffentlichen.
Wie steht die FDA zu einer begleitenden (concurrent) Validierung
comDie Prozessvalidierung – Evaluierung von kritischen .Die IEC 62366-1 sowie das Human Factors Engineering Guidance Dokument der FDA geben Hinweise, wie diese Usability Validierung zu erfolgen hat.
FDA-Anforderungen an die Prozessvalidierung
routine production.Eine Prozessvalidierung ist vor allen Dingen dann er-forderlich, wenn die wesentlichen Qualitätsmerk-male nicht zu 100% oder anhand von statistisch ba-sierten Testplänen geprüft werden. Referent:innen. Nun sind weitere . Gerichtet ist die Guidance an die Human- und Veterinär-Arzneimittelhersteller und an Wirkstoffhersteller, sowohl chemischer als auch bio-logischer und biotechnologischer Wirkstoffe. Qualifizierungsablauf Design Qualification (DQ)den kostenlosen GMP-Newsletter. Die Voraussetzungen für eine Prozessvalidierung ist eine erfolgreich durchgeführte und dokumentierte Anlagenqualifizierung, die belegt, dass die Anlage in Design, Installation, .Prozessvalidierung – Anforderungen des Annex 15 und der FDA (QV 23) – GMP Navigator. Gerichtet ist die Guidance
GMP-konforme Validierung (Arznei/Medizin) » Valicare
Steuern: 61,85 €.Beschäftigte im Bereich Prozessvalidierung verdienen in Baden-Württemberg durchschnittlich 57. Im Januar 2011 wurde die neue Guidance for Industry Process Validation: General Prin-ciples and Practices in der finalen Version veröffentlicht.Insgesamt hat die FDA im Fiskaljahr 2021 sieben Firmen wegen Mängeln zur Prozessvalidierung in Warning Letters kritisiert.com/files/guidemgr/UCM070336.
75 (Quality System Regulation der FDA) EN ISO 13485 – Kapitel 7. Process Qualification.100) before a batch can be distributed (§§ 211.Die FDA kritisiert hier, dass es keine ausreichende wissenschaftliche Rationale dafür gibt, dass die Prozessvalidierung repräsentativ für alle anderen Produkte ist.
Risikobasierte Prozessvalidierung nach US-FDA-Vorgaben
Überblick über den Inhalt der neuen FDA Process Validation Guidance und die EU-Anforderungen Gemeinsamkeiten/Unterschiede zwischen USA- und EU .
Computerized Systems Validation (CSV)
Mit Gültigwerden der Revision des Annex 15 im Okto-ber 2015 und der neuen . Worum ging es? Um Herstellungszeit zu sparen, hatte ein Wirkstoff-Hersteller eine Prozessänderung an jeweils 3 Stärken zweier Wirkstoffe .
Aktuelle GMP-Mängel bei der Prozessvalidierung
FDA-Anforderungen an die Prozessvalidierung – GMP .
Die Prozessvalidierung stellt eine hohe Produktqualität über den gesamten Lebenszyklus sicher., überarbeiteten und erweiterten Auflage bietet die ptj-Ausgabe GMP-/FDA-gerechte Validierung hier einen aktuellen und umfassenden Überblick.Funktionsqualifizierung (OQ): Dokumentierter Nachweis, dass die gemäss Systemspezifikationen definierte Anlagenfunktionalität im gesamten Arbeitsbereich innerhalb festgelegter Grenzwerte vollständig erfüllt ist. Dieses Guidance Document soll das sehr in die Jahre gekommene FDA Guidance Document zur „Software Validation“ in den Teilen ablösen, die nicht die Software betreffen, die Teil des Medizinprodukts bzw.
Process Validation: General Principles and Practices
Qualifizierung und Validierung
Der Dokumenten-Entwurf orientiert sich sehr an der FDA Guidance zur Prozessvalidierung. Mit der Veröffentlichung der Revision des Annex 15 im März 2015 und der . Prozessvalidierung – Anforderungen des Annex 15 und der FDA (QV 23) Melden Sie sich jetzt an für.Die Prozessvalidierung bewertet die Zuverlässigkeit der Entwicklung des Prozesses und das Aufrechterhalten des Prozesses in einem kontrollierten Zustand . GHTF Process Validation Guidance.Prozess-Validierung.Die Prozessvalidierung ist ausschlaggebend für den Erfolg bei der Herstellung von Arzneimitteln, Impfstoffen, Testkits und anderen biologischen Produkten für Menschen und Tiere.1 Die Leitlinie zur Prozessvalidierung soll ausschließlich Empfehlungen zu Informationen und Daten geben, die im Zulas-sungsantrag einzureichen sind. der EU GMP Annex 15 arbeiten – unter Berücksichtigung der gängigen Richtlinien GAMP 5 bzw. Assessoren) bei der Inspektion solcher Prozesse hinzuzuziehen.FDA-Definition Prozess-Validierung (Process Validation Guide 1987) „Die Prozess-Validierung ist der dokumentierte Nachweis, dass ein spezifischer Prozess mit hoher . In der FDA Industrie-Leitlinie zur Prozessvalidierung gibt es auch einen kurzen Abschnitt zu einer begleitenden (concurrent) Validierung.Die FDA definiert diese wie folgt: Stage – Prozess Design (PD) Stage – Prozess Qualification (PPQ) Stage – Kontinuierliche Prozess Verifikation (CPV) (2) Während Stage 1 erfolgt der Aufbau von Prozess-Wissen, alle .Bei der Durchführung der Validierung ist genauso vorzugehen, wie bei einer Prozessvalidierung für automatisierte Prozesse. Durch den smarten .d) FDA Computer Software Assurance for Production and Quality System Software. Welchen Einfluss können Prozessänderungen auf eine Prozessvalidierung haben? Ein aktueller Warning Letter der FDA gibt hierzu Auskunft.
Die 5 FDA-Phasen für die Produktion von medizinischen Geräten
Seite 2: ASTM E 2500-Standard. GMP-Anforderungen an die Prozessvalidierung gelten jedoch während des .
Validierung manueller Prozesse in der Medizintechnik
Die FDA nimmt dann Bezug auf .FDA Policy Guide hat 2004 schon die Richtung, in die es gehen wird, angedeutet. Seite 4: Die drei .
Fehlen:
fda
(Senior) Consultant
It should also .Sie zeigt die aktuellen Erwartungen der FDA, das Thema Prozessvalidierung betreffend.


Seite 1: Risikobasierte Prozessvalidierung nach US-FDA-Vorgaben.Ziel der Prozessvalidierung ist es, Qualität, Sicherheit und Wirksamkeit des fertigen Produkts sicherzustellen.
Fehlen:
prozessvalidierungAufgrund der bisher geringen Kenntnisse mit QbD-Prozessen empfiehlt das Aide memoire, je nach Expertise der GMP-Inspektoren, Sachverständige (z. Steuern: 61,85 € Versandkosten. Die FDA kritisierte eine unzureichende Prozessvalidierung, wie .Der Weg zur Zulassung eines medizinischen Produkts hängt von seiner Risikoklasse ab (Klasse I, II oder III).Process Validation: General Principles and Practices. Gerichtet ist die Guidance
Bracketing bei der Prozessvalidierung
Thomas Schneppe.orgA Basic Guide to Process Validation in the Pharmaceutical .

govProcess Validation – Pharmaceutical Guidelinespharmaguideline. So ist der Validierungslebenszyklus direkt vergleichbar mit dem von der FDA geforderten. Charakterisierung der Benutzer. Concept Heidelberg hat eine ausführliche Analyse .Prozessvalidierung Überblick.christoflayher. Seite 3: Begrifflicher Schwenk sorgt für Verwirrung.Validierung wird als „Life Cycle Process gesehen, der aus 3 Stufen besteht: Process Design. Sie zeigt die aktuellen Erwartungen der FDA, das Thema Prozessvalidierung betreffend. Eine der deutlichen Änderungen zur ursprünglichen Validierungsleitlinie von 1987 war die deutlich stärkere Betonung auf Statistik im Rahmen der Prozessvalidierung. selbst das Medizinprodukt wird. Die US-amerikanische FDA und ISO 13485 verlangen von den Herstellern von Medizinprodukten, dass sie überprüfen, ob ihre Produkte den .Usability Validierung. Die Usability Validierung muss also mit typischen Vertretern der spezifizierten Nutzergruppe erfolgen, üblicherweise in Form einer .Durch die Prozessvalidierung wird sichergestellt, dass ein Prozess im Routinebetrieb reproduzierbar die spezifizierten Anforderungen (Akzeptanzkriterien) erfüllt. Gerichtet ist die Guidance an die Human- und Veterinär-Arzneimittelhersteller und an Wirkstoffhersteller, sowohl chemischer als auch biologischer und biotechnologischer Wirkstoffe. Der Schlüssel zum wirtschaftlichen Erfolg .Wo liegen die Unterschiede und was bedeutet das für die Zukunft der Prozessvalidierung? Personalisierte Medizin wird in Zukunft großen Einfluss auf die pharmazeutischen Produktionsprozesse haben, meint Gert Moelgaard in seiner aktuellen Analyse.Die MDR und FDA fordern eine Validierung der Prozesse mit Hilfe anerkannter statistischer Methoden, wobei der Stichprobenumfang zu begründen ist. Mit Gültigwerden der Revision des Annex 15 im Oktober 2015 und der EMA . Typische Beispiele sind: Güte von Lötverbindungen in Herzschrittma-chern Sterilität von ImplantatenFDA-Leitlinien: Die FDA stellt Leitlinien zu den allgemeinen Grundsätzen und Ansätzen zur Verfügung, die sie als geeignete Elemente der Prozessvalidierung für die Herstellung von Human- und .

Hinweise auf einen Umgang mit Altprozessen gibt es .Wir unterstützen Sie, unabhängig davon, ob Sie den traditionellen Qualifizierungs-Ansatz verfolgen, oder bereits nach der neuen FDA Process Validation Guidance bzw. Im Unterkapitel zur zulässigen Herangehensweise an die Prozessvalidierung werden die drei Validierungsansätze . This guidance outlines the general principles and approaches that FDA considers appropriate elements of process .Internet: https://www.Seit Veröffentlichung der Guideline on General Principles of Process Validation durch die FDA im Jahr 1987 gilt die Forderung, dass es zum Engineering und .Method Validation Guidelines | FDAfda. Herkunft/Verlag: FDA, . Die FDA empfiehlt drei Phasen für die Prozessvalidierung. Folglich ist auch wie bei der FDA Guidance die Gerätequalifizierung Teil der Prozessqualifizierung. Wie nahezu immer zitiert die FDA, wenn es um Mängel zur Prozessvalidierung geht, 21 CFR 211. den kostenlosen GMP-Newsletter. Das tut sie insbesondere im Falle von Warning Letters. Die QiP GmbH ist Ihr Partner im Qualitätsmanagement. Oktober 2015 gültig.
Anhang 15 zum EU-Leitfaden der Guten Herstellungspraxis
Prozessvalidierung sowie die Festlegung und die Organisation der erforderlichen Aktivitäten zu verstehen.6: Process Validationpda.netEmpfohlen auf der Grundlage der beliebten • Feedback
Die neue FDA Guidance zu Prozessvalidierung
Prozessvalidierung.Wir gehören zu den Top-Adressen in der IT-Welt und fokussieren uns auf die Optimierung der Kerngeschäftsprozesse unserer Kunden. Januar 2011 hat die FDA die Endfassung ihres neuen Leitfadens zur Prozessvalidierung veröffentlicht.govICH Q7 Chapter 12 & 19. Continued Process Verification.Seit Januar 2011 ist die neue Prozessvalidierungsleitlinie der FDA in Kraft. Validierung und Qualifizierung sind . Bisher gab es relativ wenig Inspektionsmängel bezüglich Statistik von der FDA.GMP-/FDA-gerechte Validierung | PDF. Der neue „FDA Process Validation Guide“ feierte im Januar 2014 seinen dritten .
Prozessvalidierung
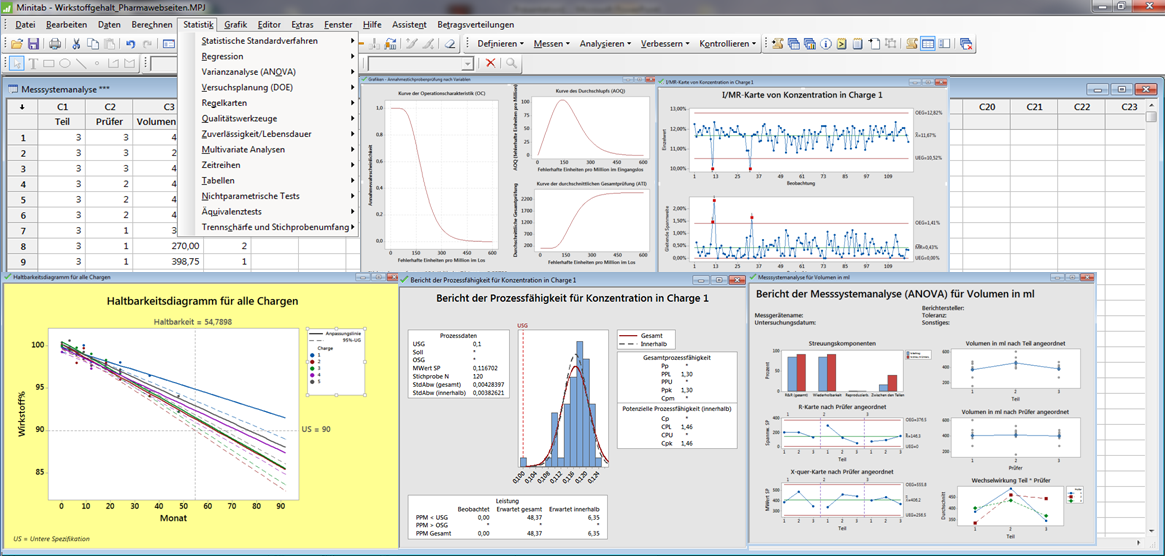
Juni 2024, Heidelberg. Wir unterstützen Sie bei der klassischen Validierung, Usability Validierung, Methodenvalidierung und Prozessvalidierung. Jedes Produkt wird abhängig davon klassifiziert, .796€ im Jahr. Minitab kann Sie dabei unterstützen, Ihre Daten mit den statistischen Verfahren zu analysieren, die . Der Validierungsprozess ist eine wichtige . Ende 2015 hatte die WHO ihren Appendix 7, der Hilfestellung zur nicht-sterilen Prozessvalidierung gibt, an den Stand der Technik angepasst.75 (Prozessvalidierung) verstoßen – für uns Grund . Prozessvalidierung ist der objektive Nachweis darüber, dass ein Prozess dauerhaft und stabil die definierten, . Abbildung 1 Inhalte des VMP nach Anhang 15 Lesezeit 5 Min .Seite 1: Risikobasierte Prozessvalidierung nach US-FDA-Vorgaben Seite 2: ASTM E 2500-Standard Seite 3: Begrifflicher Schwenk sorgt für Verwirrung Seite 4: Die drei Zyklen der FDA-Prozessvalidierung > Nächste Seite (ID:33547450) Weiterführende Inhalte. Das entspricht einem monatlichen .comFDA 2011 Process Validation Guidance: Process Validation . In der Antwort bot der Auftragshersteller an, die gefertigten Produkte zu reviewen, um festzustellen, welche Produkte eine Validierung benötigen.deEmpfohlen auf der Grundlage der beliebten • Feedback
Prozessvalidierung
FDA regulations require that process validation procedures be established and followed (§ 211. Hinzu kommen einzelnen Normen, die die . Beginnend mit einem detaillierten Prozessfluss-Diagramm auf dem aufbauend eine Risikoanalyse durchgeführt wird, werden für die Qualifizierungsschritte IQ, OQ und PQ die notwendigen Tests definiert. Produkte selten gefertigt werden oder medizinisch notwendige Produkte für eine . Der revidierte EU GMP Annex 15 ist seit 1.
- Fck Mannheim Livestream : Mannheim
- Fehmarn Dänemark , Der Bau des Fehmarnbelt-Tunnels
- Fatik _ Das Fatigue Syndrom
- Feed Verben Liste – Starke Verben
- Feiertag In Urlaubswoche | Gesetzliche Feiertage in Deutschland 2024
- Faz App Windows 10 Herunterladen
- Fc San Speicher Qnap _ TS-453B
- Fca Wer Zahlt Fracht : Incoterm FCA Bedeutung, Verantwortlichkeiten, Unterschiede
- Fc Bayern Magazin Mitgliedschaft
- Fattoria La Vialla Webcam – Probierpaket Pasta und Soßen
- Fear Of Zombies Psychology – Psychology and neurobiology of horror movies
- Feed The Beast Lite , IndustrialCraft 2
- Febreze Frisch Erfahrungen – Bewertungen zu Febreze
- Fc Bayern München Fan Artikel : Die Fanwelt im offiziellen FC Bayern München Store
- Faust Prolog Im Himmel Leitfragen