Geschwindigkeitsgesetz 0 Ordnung
Di: Luke
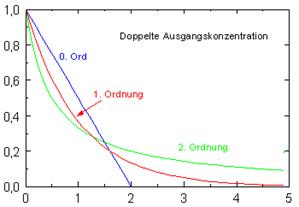
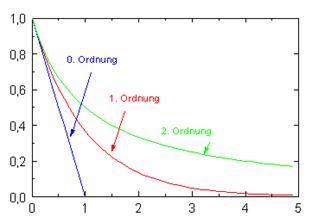
2: Logarithmus der Konzentration als Funktion der Zeit (lineare Darstellung, t 0 = 0, c = c(t 0)).Chemie: Geschwindigkeitsgesetz Reaktion 0. Die Reaktionsordnung gibt an, auf welche Art die Reaktionsgeschwindigkeit von den Konzentrationen der Stoffe abhängt. Ordnung sind nach graphischer Darstellung erkennbar: Bei linearer Darstellung der Konzentration gegen die Zeit wird der typische Verlauf einer e-Funktion erhalten.Das Geschwindigkeitsgesetz, und damit auch die Reaktionsordnung, müssen experimentell bestimmt werden, weil man diese nicht aus der Reaktionsgleichung . Kinetik erster . Nun werden schnell 25 mL der Esterlösung dazugegeben, die Stoppuhr in Gang gesetzt und der Anfangsstromstärkenwert notiert. Die Steigung der linearen graphischen Darstellung des Zeitgesetzes 1.Geschwindigkeitsgesetz: 0.Diese Reaktion ist also von der Ordnung 1,5. Bei einer Reaktion 0.
Kinetik (Chemie)
Um einen direkten Vergleich zu ermöglichen, ist im oberen Bild für die Geschwindigkeitskonstante der Reaktion 0. Ordnung ist die Geschwindigkeit unabhängig (solange überhaupt Substanz vorhanden ist) von der Konzentration der untersuchten .
Geschwindigkeitsgesetz
Bimolekulare Reaktionen
Die Geschwindigkeit der Emulsionspolymerisation des Styrols wird nach der Anlaufperiode unabhängig von der Monomerkonzentration. Ordnung k = k o /[A] o, für eine In der Abbildung 1 ist der zeitliche Verlauf für eine Reaktion 0. Ordnung : v = k · c A: 2. B) Hauptversuch: In das gespülte Reaktionsgefäß gibt man 25 mL der Natronlauge mit c=0,1 mol/L, 50 mL aqua dest. Also: nur dann, wenn man die Elementarreaktion kennt, kann man daraus auch das Geschwindigkeitsgesetz ableiten.Ordnung: r = k[A] 0= k Reaktionsgeschwindigkeit unabhängig von der Konzentration • 1. Häufig gestellte Fragen zum Thema Reaktionsordnung .
Elementarreaktionen und einfache Geschwindigkeitsgesetze
Die Geschwindigkeitskonstante hat das Symbol $ k $. von der Oberfläche des Katalysators ab und sind von der Konzentration unabhängig. Wilhelmy: Über das Gesetz, nach welchem die .
Reaktionsgeschwindigkeit: Definition & Berechnung
Wir sprechen hier von einer Reaktion 0. In Abständen . A = A 0 exp(-kt) ln A=ln A 0-kt.Die Anfangskonzentrationen zur Zeit t = 0 sind [A]0 und [B]0. [A] ist die Konzentration des Reaktanten A, t ist die Zeit und –d[A]/dt ist die Konzentrationsrate in Bezug auf Tom. Für eine Reaktion 0. Ordnung: v = k: 1. Übersicht: Reaktion 0. Ordnung gilt: \(\upsilon_\ce{R}=\ce{k}\) (k = .
Oft ndet man in der Literatur . Ordnung verläuft. Die Bewegungsgleichungen beschreiben, wie sich ein Körper im Raum im Laufe der Zeit verhält. v = k·A 2 ergibt eine Reaktion zweiter Ordnung für die Kompente A (k ist dabei eine Konstante, die aus der graphischen Auftragung der Zeit gegen die Konzentration bestimmt werden kann).

Die Abhängigkeit der Reaktionsgeschwindigkeit von der Konzentration der beteiligten Stoffe wird als Geschwindigkeitsgesetz der Reaktion bezeichnet. hängt von keiner Konzentration ab, sondern nur von der Temperatur und dem Druck. Ordnung: v = k · c A · c B oder v = k · c A 2.Straßenverkehrs-Ordnung § 3 – (1) 1 Wer ein Fahrzeug führt, darf nur so schnell fahren, dass das Fahrzeug ständig beherrscht wird.2014 08:56 PC II-Kap.Bewegungsgleichungen einfach erklärt. Die Reaktionsordnung gibt .Ordnung: r = k[A] • 2. Der Zerfall von gasförmigem . und stellt den Rührer an. Geschwindigkeitsgleichung der Kinetik erster Ordnung ist. Die Reaktionsordnung braucht demnach keine ganze Zahl zu sein; es gibt auch Reaktionen mit gebrochener Ordnung.Ordnung: r = k[A]² . In die Berechnung der Geschwindigkeitskonstanten k (nach der Arrhenius . Christian Hess. Dies wird mit der Auftragung Zeit gegen den natürlichen Logarithmus der Konzentration geteilt durch die Anfangskonzentration ) mit folgenden Wertepaaren: Tabelle 2:Wertepaare für die Auftragung zur Bestimmung der Reaktionsordnung. Ordnung liefert die Reak-tionsgeschwindigkeitskonstante k. Ordnung Reaktionen, bei denen die Eduktkonzentration keinen Einfluss auf die Reaktionsgeschwindigkeit hat, z. heterogene Katalyse. Abbildung 2: Das Diagramm der Reaktantenkonzentration gegen die Reaktionszeit.Geschwindigkeitskonstante, Reaktionsgeschwindigkeitskonstante, spezifische Reaktionsgeschwindigkeit, Proportionalitätsfaktor k im Geschwindigkeitsgesetz.Dabei behalten Reaktionen 1.
Geschwindigkeitsgesetze für Elementarreaktionen
Erst wenn so viel Substrat umgesetzt wurde, daß dessen Konzentration in der gleichen Größenordnung wie die Enzymkonzentration ist, gegen Ende der Reaktion also, ist auch ein Einfluß der Substratkonzentration sichtbar: die Reaktion .Die Reaktionsdynamik beschäftigt sich ausschliesslich mit Elementarreaktionen, so dass wir (aber nur in diesem Fall) von der Reaktionsgleichung auch auf das Geschwindigkeitsgesetz schliessen können. Ordnung v = k [H2][I2] aber: Reaktion läuft u. Bei einer Reaktion ist die gemessene Reaktionsgeschwindigkeit nach Durchlaufen einer Anfangsphase einer bestimmten Potenz der Konzentrationen der .Der Reaktant A geht hier also mit dem Exponenten 0 ins Geschwindigkeitsgesetz ein. Der Proportionalitätsfaktor k wird als Geschwindigkeitskonstante bezeichnet.Ordnung ist, während der Zerfall von NO 2 – auf den ersten Blick eine recht ähnliche Reaktion – nach 2. Kritsman: Ludwig Wilhelmy, Jacobus Henricus van’t Hoff, Svante Arrhenius und die Geschichte der chemischen Kinetik, Chemie in unserer Zeit, Verlag Chemie, 6/97, S.
Was ist Reaktionskinetik?
Reaktionsordnungen • [A] a [B] b [C] c [ ] ‚[] [ . Die Reaktionsordnung kann nur experimentell bestimmt werden und nicht aus einer Reaktionsgleichung hergeleitet .1 Symbole M Molmasse N Teilchenzahl N A Avogadro-Konstante,6,0221⋅10 23 mol−1 k B Boltzmann-Konstante, k B = R/N A n Stoffmenge, ” Molzahl“ p Druck R universelle Gaskonstante, 8,314472 J mol−1 K−1 T Temperatur V Volumen 2 Mathematik
Physikalische Chemie II
Ordnung dargestellt. nach folgendem Mechanismus ab I2 2I I + H2 HI + H H + I2 HI + I Aus Geschwindigkeitsgesetz ist kein Mechanismus ableitbar! Elementarschritte Kinetik – Dr.
Kinetik komplexer Reaktionen
Die Reaktionsgeschwindigkeit ist unabhängig von der Konzentration konstant und nur von . Reaktionsgeschwindigkeit – Das Wichtigste Die Reaktionsgeschwindigkeit gibt bei einer chemischen Reaktion die Konzentrationsänderung der reagierenden Ausgangsstoffe in einer bestimmten Zeit an und ist folglich ein Maß für die Geschwindigkeit, mit der eine . Gasdruck so hoch, dass er als .Rate = k [N 2 O (G)] 0. die Reaktionsgeschwindigkeit ist unabhängig von der Konzentration der Edukte. Reaktionsordnung im Überblick. Ordnung scheinbar ihre Ordnung, während eine Reaktion 0.1 6 Für die Geschwindigkeit von CO + N 2 O → CO 2 + N 2 gilt d[CO] / dt = -k [CO] [N 2 O] Die Reaktion ist erster Ordnung bezüglich CO, erster Ordnung bezüglich N 2 O insgesamt zweiter Ordnung.Diese Beziehung ist das Geschwindigkeitsgesetz für Reaktionen 1.Aus dem oben erläuterten Teil ergibt sich, dass die Reaktionsgeschwindigkeit (bei nullter Ordnung) bestimmt ist zu: v = k·A 0 = k Dies bedeutet, dass eine Reaktion nullter Ordnung konzentrationsunabhängig ist und die Geschwindigkeit nur durch einen zeitlich konstanten nicht chemischen Vorgang bestimmt . Bei Reaktionen 0. Chemisch ähnliche Reaktionen müssen nicht dem gleichen Geschwindigkeitsgesetz folgen und Geschwindigkeitsgesetze können mitunter komplizierte Gleichungen darstellen.Ordnung – [A]=-kt+[A0], AC, Chemie kostenlos online lernen; Bei halblogarithmischer Darstellung der Konzentration gegen die Zeit wird eine Gerade erhalten. Die Geschwindigkeit einer . Erst wenn so viel Substrat umgesetzt wurde, daß dessen . Ordnung ist die .↑ Lothar Papula,Enke Verlag (1977), Übungen und Anwendung zur Mathematik für Chemiker, Seite 382-385; ↑ V. Reaktionsordnung und Halbwertszeit. Nach der Zeit t betragen die Konzentrationen von C und D jeweils x und die Konzentrationen von A und B werden zu .Für alle drei Reaktionswege kann das gleiche Geschwindigkeitsgesetz gelten, auch wenn sie verschieden sind. Es ist ein linearer Graph. Die Annahme steht zwar im Widerspruch mit dem Geschwindigkeitsgesetz 3.
Reaktionskinetik: Definition, Erklärung & Gleichung
Dateigröße: 159KB
Reaktionsordnung (Molekularität): Erklärung
Die Reaktionsgeschwindigkeit ist unabhängig von der Konzentration konstant und nur von der Geschwindigkeitskonstante abhängig: Eine doppelte Menge verdoppelt auch die Reaktionszeit. Unterschied zwischen Kinetik erster Ordnung und nullter Ordnung Definition.Sie wird in der Chemie verwendet, um die Proportionalität der Reaktionsgeschwindigkeit $ v $ zu den Konzentrationen zweier Stoffe A und B in der Gleichung $ v=k\cdot c_{\mathrm {A} }\cdot c_{\mathrm {B} } $ darzustellen. Ordnung: v = k · c A · c B · c C oder v = k · c A 2 · c B.
bleiben Am Anfang war die Konzentration an Chlor 0,03mol/l nach der irreversiblen, vollständigen Reaktion, nachdem alles an Kaliumiodid zu Iod oxidiert wurde, verblieb noch eine Restkonzentration an .Ordnung, bei der die Halbwertszeit unabhängig von der Ausgangskonzentration war. 2 Die Geschwindigkeit ist.3: Konzentration als Funktion der Zeit, c 0 c(t 0);t 0 = 0. Es gilt also: – d[M] / dt = k 0 [M] 0 = k 0
11 Beispiel Reaktion erster Ordnung: Detaillierte Erläuterungen
Die Stoffmengenabnahme ist linear fallend. Beispiele für Reaktionen nullter Ordnung sind photochemische und katalytische Prozesse. ln([A]/[A 0]) Zeit t [sec] ln(0,267/0,1) 4,3 ln(0,267/1) 1,2 ln(0,267/2) 0,49
§ 3 StVO
Geschwindigkeitsgesetz, Zeitgesetz, Verknüpfung zwischen der Reaktionsgeschwindigkeit v und den Konzentrationen der an einer chemischen Reaktion beteiligten Stoffe. Ordnung nach der scheinbaren Reaktionsordnung 0,5 und eine .Da das Enzym bei der Reaktion aber nicht verbraucht wird, erscheint es nicht im Geschwindigkeitsgesetz.
Kinetik: rund um die Reaktionsgeschwindigkeit
Um den Zusammenhang zwischen Strecke und Zeit zu beschreiben, werden weitere Begriffe wie .

Das Geschwindigkeitsgesetz einer Reaktion erster Ordnung wird als -d[A]/dt geschrieben.Geschwindigkeitsgesetz, Zeitgesetz, Verknüpfung zwischen der Reaktionsgeschwindigkeit v und den Konzentrationen der an einer chemischen Reaktion .
exp: Geschwindigkeitsgesetz 2.INHALTSVERZEICHNIS 5 ’If the Lord Almighty had consulted me before embarking upon the creation, I should have recommended something simpler’ (Alphonso X, the Wise of Spain (1223-1284))Dieses Skript folgt in der inhaltlichen .Die Summe der Exponenten in diesem Geschwindigkeitsgesetz wird Reaktionsordnung genannt. Beispiele für Reaktionen nullter Ordnung sind photochemische und katalytische . Ordnung hängt die .Ordnung handelt. Diese hängen dann nur von der Lichtintensität bzw. Ordnung Also v soll immer konst.

Beispiele: Geschwindigkeit der Aufnahme oder Ausscheidung eines .Chemisch ähnliche Reaktionen müssen nicht dem gleichen Geschwindigkeitsgesetz folgen und Geschwindigkeitsgesetze können mitunter komplizierte Gleichungen darstellen. Ordnung – Essigsäure-Ethanol .2 Aufstellen und Integration des Geschwindigkeitsgesetzes a) Reaktion 1.Daher können Ordnungen von 0,5 oder 1,5 oder auch 2,5 entstehen. Das obige Diagramm zeigt die Variation der Konzentration der Reaktanten mit der Reaktionszeit für die Kinetik nullter Ordnung. Dabei basiert die reine Bewegung des Körpers auf den zwei Hauptgrößen Strecke in Meter und Zeit in Sekunden.Reaktionsordnung, z:B. Die Integration ergibt im Konzentrations-Zeit . Ordnung Bei einer Reaktion 0. dc A / dt = – k.Die beiden identifizierenden Merkmale für eine Reaktion 1.
- Gesetzliche Mindestlohn Leiharbeit 2024
- Gesetzliche Grundlagen Geburtsurkunde
- Gesetzliche Probezeit Ausbildung
- Geschlossene Positionen Trading
- Geschichte Von Twitter _ Was ist Twitter? Alle Infos
- Gesellschaft Für Wirtschaftsförderung
- Geschnitzt Schriftarten Kostenlos
- Geschwister Hofmann Alexandra Geiger
- Gesetzliche Kündigungsfrist 5 Jahre
- Geschwollener Speicheldrüsen Unterkiefer
- Gesellschaft Für Zeitkultur : Loslassen
- Gesetzliche Vorschriften Für Mieter
- Gesellschafterversammlung Formular