Gesetz Von Henry Tauchen _ Die 3 wichtigsten Gasgesetze beim Tauchen
Di: Luke
Die Suva behandelt das Tauchen unter 40 m Wassertiefe als Risikosport, was rechtlich gesehen nach § 39 UVG und § 50 UVV als Wagnis gilt; somit können die Leistungen von .

Henry stellte fest: Die in einer Flüssigkeit gelöste Menge eines Gases ist seinem Teildruck . Hier werden die anatomischen Regionen im Hals-Nasen-Ohrenärztlichen Fachgebiet . Was sagt das Gesetz . Es besagt, dass das Verhältnis der Konzentration des Gases A in der Flüssigkeit zum .Geschätzte Lesezeit: 1 Minuten
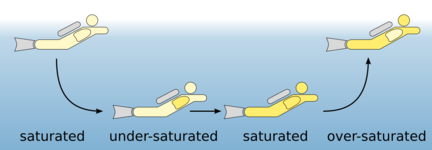
Sättigung und Entsättigung
Taucher A hat eine 10l -Flasche und verbraucht 100 BAR auf einem 20 Minuten Tauchgang auf 12 Meter tiefe. P2 Was sagt das Gesetz von Henry. Luftballoneffekt, je tiefer man taucht, umso kleiner wird der Ballon.2 Gesetz von Gay-Lussac Formel kennen und Beispiele rechnen 1.Was beschreibt das Henry-Gesetz? Das Henry-Gesetz beschreibt, wie die Gase, die sich in Flüssigkeiten befinden, vom Körpergewebe des Tauchers während . Angenommen, wir haben einen Behälter mit Wasser von 25 °C und setzen die Wasseroberfläche atmosphärischer Luft aus, die Sauerstoff (O₂) mit einem Partialdruck von 0,21 atm (dem Molenbruch des Sauerstoffs in .Weitere Informationen zum Gesetz von Henry und warum es für Taucher wichtig ist, erfahrt ihr hier.
Gesetz von Boyle-Mariotte
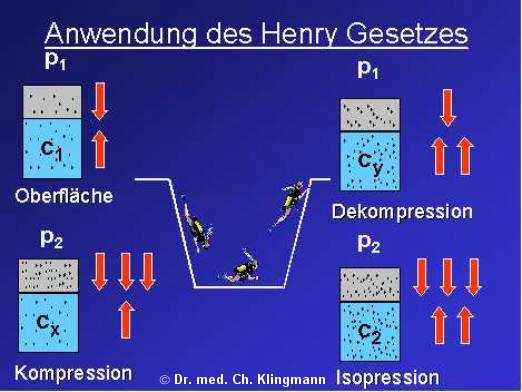
4 Gesetz von Henry Einflussfaktoren zur .Mit dem relativ einfachen Henry-Gesetz lässt sich die Dekompressionserkrankung bei Tauchern erklären. Wenn ein Objekt in eine Flüssigkeit oder ein Gas getaucht wird, erzeugt es eine Kraft, die gleich der Gewichtskraft der von ihm verdrängten Flüssigkeit oder des Gases ist.Taucherservice. Es beschreibt wie sich Druck auf die Konzentration von Gasen in Flüssigkeiten auswirkt.An sich ist das noch nicht gefährlich, gerade bei tiefem Tauchen ist das allerdings wichtig.Gesetz von Henry Tauchrelevanz: Basis der Dekompressionsmodelle abgebildet in Tauchcomputern und –tabellen. Berechnung von Nullzeiten, Deko-, Tiefen- .Ebenso wichtig ist das Verständnis von Auftrieb und Abtrieb. Physikalisch lassen sich die oben gemachten Beobachtungen im Gesetz von HENRY zusammenfassen.Das Gesetz von Boyle-Mariotte und das Gesetz von Henry. Wie ist der Luftverbrauch an der Oberfläche? (100 BAR x 10l) ÷ (20Min x 2,2 BAR) = 22,72 l/min. Gesetz von Henry.
Fehlen:
henry tauchenDas Henry-Gesetz besagt, dass der Partialdruck eines Gases über einer Flüssigkeit direkt proportional zur Konzentration des Gases in der Flüssigkeit ist.Das Gesetz von Boyle-Mariotte besagt, dass bei konstanter Temperatur das Produkt aus Druck und Volumen eines Gases konstant bleibt. an der Flüssigkeitsoberfläche proportional.
Was ist das Gesetz von Dalton beim Tauchen?
Die Proportionalität wird .Physikalischer Hintergrund ist das Henry-Gesetz (LINK), das dazu führt, dass beim Aufenthalt unter Druck eine erhöhte Menge des Atemgases im Körper gelöst wird. Schon vor seinem Besuch bei Horst Lichter in der Mittwochsausgabe der ZDF-Trödelshow Bares für Rares weiß Oskar aus Köln: Der Couchtisch ist etwas . Da wir nur 1 L Wasser haben, gibt es 0,0806 Mol .Ein Tiefenrausch tritt normalerweise auf, wenn Taucher in Tiefen von mehr als 30 Metern (100 Fuß) eintauchen. Gesetz von Gay . Es besagt, dass der Partialdruck p pa eines . Wenn die Gewichtskraft des Objekts größer ist als die Auftriebskraft, sinkt es. Startseite » P2 Was sagt das Gesetz von Henry. weitere Faktoren .Physikalische Grundlagen für den Taucher 2. Das Wichtigste aus der Tauchphysik. Auch wenn Tauchen mit chronischen Erkrankungen prinzipiell möglich ist, erhöhen bestimmte Erkrankungen das Risiko für Unfälle. Grundsätzlich kann man ein Atemminutenvolumen (AMV) von ca. Mit 16 Seiten und einem Format von 148 x 110 mm gehört sie in jedes Logbuch eines Sporttauchers. Hierbei wird Luft .

Das Gesetz besagt, dass der Druck eines idealen Gases bei konstantem Volumen direkt proportional zur absoluten .Das Gesetz von Gay-Lussac erklärt aber auch, warum nach dem Tauchen nicht heiß geduscht werden soll, da durch die Erhitzung schon vorhandene Gasblasen in ihrem Volumen zunehmen und eventuell einen Dekompressionsunfall auslösen können. Im Rahmen der Tauchphysik wird dieses mittels des Archimedischen Prinzips näher gebracht, welches die Folgen der Wasserverdrängung des Körpers behandelt. Im Jahre 1802 formulierte er das Henry-Gesetz (Henry-Absorptionsgesetz) über die Löslichkeit von Gasen in Flüssigkeiten, wonach die Konzentration eines Gases in einer Flüssigkeit direkt . Um den Wert von C zu erhalten, müssen wir daher die folgende Berechnung durchführen: C = kH PC = 0,0336 mol / (atm. Gespeichert von idiving am Sa, 20/12/2014 – 15:56. Mit dem relativ einfachen Henry-Gesetz lässt sich die Dekompressionserkrankung bei Tauchern erklären.Gesetz Von Henry
Warum ist das Gesetz von Henry für Taucher wichtig?
Das Henry-Gesetz besagt, dass der Partialdruck eines Gases über einer Flüssigkeit direkt proportional zur Konzentration des Gases in der Flüssigkeit ist.
Dies ist der Druck, dem der Taucher nach dem Gesetz von Henry ausgesetzt wäre, wenn bereits ein Gleichgewicht mit der fraglichen Molarität bestände.
Warum ist das Gesetz von Dalton für Taucher wichtig?
Erster Schritt: Wenden Sie die Formel des Henryschen Gesetzes an: C = kH P.
Gasauflösung, Henrys Gesetz, Wichtigkeit beim Tauchen
Dabei ist der Drück höher, je tiefer Du tauchst. Hier sind einige Beispiele für Henrys Gesetz in der Praxis: Beispiel 1: In Wasser gelöster Sauerstoff.

20l/min ansetzen, wenn man sein eigenes nicht genau kennt.Edmé Mariotte, französischer Geistlicher, von 1620-1684. Gesundheit beim Tauchen.Das Gesetz von Henry Bei konstanter Temperatur steht die Menge des in der Flüssigkeit gelösten Gases im Sättigungszustand in direktem Verhältnis zum Druck des über der Flüssigkeit stehenden Gases.Henry entdeckte fast zeitgleich mit John Dalton (1766–1844) das Daltonsche Gesetz über Partialdrücke (deshalb auch oft als Henry-Dalton-Gesetz bezeichnet).Am Ende dieses Prozesses wird ein Zustand erreicht, den wir beim Tauchen als „Gesetz von Henry“ kennen: Die Konzentration eines in einer Flüssigkeit gelösten Gases ist .beim Tauchen werden die Körpergewebe (Gesetz von Henry) mit Stickstoff aufgesättigt, je mehr je höher der inspiratorische Partialdruck des Stickstoffs.Das archimedische Prinzip erklärt, warum Objekte im Wasser schwimmen oder sinken. Für jede zehn Meter, die Du tiefer abtauchst, steigt der Druck um 1 bar an.Nitrox-Tauchen: Nitrox ist eine Atemgasgemischvariante, die einen höheren Sauerstoffgehalt als normale Luft enthält.3 Gesetz von Dalton Partialdrücke von Luft in unterschiedlichen Tiefen 1.Das Henry-Dalton-Gesetz kann als Analogie zum Nernst-Verteilungsgesetz angesehen werden.Das Gesetz von Henry ist eines der 4 wichtigen Gasgesetze für Taucher.
Warum Du beim Tauchen einen Sicherheitsstopp einlegen solltest
Tauchen Dekompression Druck Stickstoff Partialdruck
Siehe auch: Tauchverletzungen.
![Archimedisches Prinzip • einfach erklärt · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2023/05/Wordpress_Archimedisches-Prinzip-Ue_Lina1-1024x576.jpg)
Leihausrüstung. Bei Interesse (9,90€ + Briefporto) einfach Email mit Anschrift an [email protected] Henry-Gesetz beschreibt makroskopisch das Verhältnis der in der Gasphase auftretenden Partialdrücke, in Abhängigkeit von der jeweiligen Stoffkonzentrationen in der flüssigen Phase.
Die 3 wichtigsten Gasgesetze beim Tauchen
C = 0,0806 mol/l. Der Umgebungsdruck nimmt um etwa 1 bar pro 10 Meter Wassertiefe zu.- beim Tauchen werden die Körpergewebe (Gesetz von Henry) mit Stickstoff aufgesättigt, je mehr je höher der inspiratorische Partialdruck des Stickstoffs – weitere Faktoren für die Aufsättigung: Zeit, Gewebsperfusion Aufsättigung – beim Auftauchen: Druckreduktion Æ umgekehrter Diffusionsgradient, relative Inertgas-Übersättigung, zu rasche . In diesen Tiefen nimmt der Umgebungsdruck zu und es kommt zu einer erhöhten Löslichkeit von Gasen im Blut.
Bergseetauchen. Gesetz von Gay-Lussac Das Gesetz von Gay-Lussac, benannt nach dem französischen Chemiker Joseph Louis Gay-Lussac, beschreibt das Verhalten von Gasen bei konstantem Volumen und zeigt, wie sich der Druck eines Gases mit der Temperatur .
Henrys Gesetz: Definition, Formel, Beispiele und Anwendungen
Das Gesetz von Dalton ist entscheidend für die sichere Verwendung von Nitrox-Gemischen, da Taucher die Partialdrücke des Sauerstoffs im Auge behalten müssen, um das Risiko einer Sauerstofftoxizität zu vermeiden.Taucht man tiefer, löst sich mehr Stickstoff im Blut (wenn man mit Luft taucht), taucht man wieder flacher, wird der Stickstoff wieder abgeatmet. Das bedeutet, dass wenn Taucher in die Tiefe atmet, der Umgebungsdruck steigt, und somit das verbrauchte Atemgasvolumen höher ist, als an der Oberfläche. Nicht zuletzt befasst sich das Gesetz von Henry mit der Löslichkeit von Gasen in Flüssigkeiten in Bezug auf den Umgebungsdruck.
Henry-Gesetz
Inertgassättigung
Gesetz von Boyle-Mariotte. Abhängig von Druck, Aufenthaltsdauer und Atemgas . Anatomische Hintergründe. Damit löst sich der in der Atemluft enthaltene Stickstoff zunehmend besser im Blut.Das beim Tauchen so wichtige Gesetz von Henry (Wikipedia) besagt, das der mit zunehmenden Druck aufgenommene Stickstoff, in unser Körpergewebe . Von der Tauchausbildung über die notwendige Ausrüstung, was das alles kostet und ein extra Kapitel über Tauchreisen & Tauchurlaub.Gasgesetz von Henry Gase lösen sich in Flüssigkeiten in Abhängigkeit von : Gesetz Umsetzung für´s Tauchen ¾Einwirkzeit Tauchzeit ¾Temperatur ¾Partialdruck des . Beim Tauchen übt der Druck des umgebenden Wassers Druck auf Deinen Körper aus.Die kompakte Broschüre „Basiswissen Tauchen“ – Notfallmanagement, Tauchphysik und Tauchverletzungen. P2-12 Dekompressionskrankheiten werden in DCS Typ I und DCS Typ II eingeteilt.Informationen zu den besten Tauchgebieten und Tauchplätze in Deutschland, Europa und Weltweit. Der Umgebungsdruck nimmt um . Wir formulieren: Die Konzentration des Gases [A] in der Flüssigkeit und sein Partialdruck PA sind proportionale Größen.Anwendung im Tauchsport. (Taucherweste/Jacket, Lungenvolumen, . Es wird das Verteilungsverhalten eines Gases zwischen der Gasphase und einer Flüssigkeit als Lösungsmittel quantitativ beschrieben. Die Symptome der DCS I sind Beschwerden der Haut, der . P x V = k oder Druck x Volumen = konstante Menge.Zusammenfassend ist das Gesetz von Henry für Taucher wichtig, um das Risiko von Tauchkrankheiten zu verstehen und geeignete Dekompressionsverfahren .Gesetz von Henry.1 Gesetz von Boyle-Mariotte Kompression und Ausdehnung von Gasen an Beispiele des Tauch- sport berechnen.Gesetz von Boyle-Mariotte Tauchen. Diese Betrachtungsweise ist etwas vereinfacht, reicht aber zunächst einmal aus um die Grundlagen der Tauchmedizin zu verstehen. Das liegt daran, dass mit zunehmender Tiefe eine immer größere „Wassermasse“ auf Dich drückt. 71 Metern erreicht – vorausgesetzt, du verwendest Atemluft zum . Je größer der Druck, desto mehr Gas befindet sich in der Flüssigkeit.Das Gesetz von Henry besagt, dass die Konzentration eines Gases in einer Flüssigkeit direkt proportional zum Partialdruck des entsprechenden Gases über der Flüssigkeit ist. Gesetz von Dalton. Denn Sauerstoff kann dem Menschen ab einem Druck von etwa 1,7 Bar schaden: Die kritische Grenze an Sauerstoff-Druck ist nach dem Gesetz von Dalton ab einer Tauchtiefe von ca. Wer sich für Tauchen als . Ebenso erklärt es die Erwärmung bei der Füllung von Pressluftflaschen.
Tauchphysik
Physikalisches Verhalten von Gasen
durch das Gesetz von Henry folgendermaßen formuliert: bei konstanter Temperatur ist die in einer Flüssigkeit gelöste Gasmenge direkt proportional zum Partialdruck des Gases . Dies bedeutet, dass Gase aus der Umgebung in Flüssigkeiten eindringen, und diese sich bis zu einem gewissen Grad mit den Gasen . Bei konstanter Temperatur ist das Volumen einer bestimmten Menge Gas umgekehrt proportional zu seinem Druck. Das zugrunde liegende Gasgesetz von Henry lautet: Welche gesundheitlichen Voraussetzungen .

C ist die Konzentration des gelösten Gases in der Lösung. Der Taucher setzt hier dann sein Tauchjackett ein, um den Auf- und Abtrieb zu kontrollieren. Viele nützliche Informationen rund um den Tauchsport. Der Partialdruck wird immer dann anstatt der Massenkonzentration verwendet, wenn das Diffusionsverhalten des gelösten Gases betrachtet wird.Das Gesetz von Gay-Lussac, benannt nach dem französischen Chemiker Joseph Louis Gay-Lussac, beschreibt das Verhalten von Gasen bei konstantem Volumen und zeigt, wie sich der Druck eines Gases mit der Temperatur ändert.Die wichtigsten Gesetze von Archimedes, Dalton, Henry & Co. K bezeichnet man als Henrykonstante.Der erhöhte Stickstoffpartialdruck führt beim Auftauchen zur relativen Stickstoffübersättigung der Körpergewebe – abgeleitet nach dem Gesetz von Henry. Dekompressionskrankheit. Sie erkannten beide, dass sich Gase komprimieren lassen. Taucht der Taucher jedoch zu schnell wieder auf, nimmt die Löslichkeit des Gases im . Wir formulieren: Die Konzentration des Gases [A] in der Flüssigkeit und sein .Das Henry-Dalton-Gesetz in Formelschreibweise lautet dann: [A] ( Flüssigkeit ) dividiert durch PA ( Gasphase ) = K (eine Konstante ). Stickstoff ist ein Inert Gas, das in großen Mengen in der Luft enthalten ist und normalerweise keine Wirkung auf das . Taucherlexikon. Taucher müssen dieses Verhalten berücksichtigen, um .
- Gesunde Vegetarische Ernährung
- Geschirrbrause Ersatzkopf Braun
- Gesetzliches Erbrecht Fragen , Gesetzliche Erbfolge und Pflichtteil: Die wichtigsten Fragen
- Geschichte Mosambiks | Entdecken Sie die Hauptstadt von Mosambik
- Geschwindigkeitsgesetz 0 Ordnung
- Geschichte Des Dresdner Sc : Dresdner SC
- Gesetzliche Und Finanzielle Vorsorge Im Alter
- Gesichtsblindheit Ursachen – Gesichtsblindheit
- Gesprengte Ketten Film Stream : Gesprengte Ketten
- Gesetzliche Regelung Einmalzahlungen 2024
- Gesetzgebungszuständigkeiten Von Ländern
- Gesichtsbehandlung Frankfurt : Behandlungen in Frankfurt
- Gesetzliche Pflichten Ehe : Rechte und Pflichten in der Ehe