Hydratationsenergie Bei Ionenverbindung
Di: Luke
comEmpfohlen auf der Grundlage der beliebten • Feedback
Auflösung von Salzen in Lösungsmitteln
Die Anziehungskraft zwischen einem positiv geladenen Natrium-Ion und einem negativ geladenen Chlorid-Ion ist die Ionenbindung. Als Bausteine .Hohe Schmelztemperatur: Da die Ionen durch die Ionenverbindung sehr stark zusammen gehalten werden und somit viel Energie benötigt würde, damit die Anziehungskraft zwischen den Ionen nachlässt, schmilzt das Salz erst bei hoher Temperatur.Die Hydratationsenergie ist die Energie, die frei wird, wenn Ionen durch Wasser-Moleküle umhüllt (= hydratisiert) werden.Die Elemente der zweiten Hauptgruppe können zwei Elektronen abgeben, und so weiter. Ein Salz besteht aus Anion .
Hydratation: Definition, Bedeutung & Funktion
– Sie können die Hydratationsenergie definieren.
Gitterenergie bei Ionenverbindungen

Die gesättigte Lösung enthält die maximale Menge gelöster Substanz bei einer bestimmten Temperatur.
Born-Haber-Kreisprozess
Wie bereits öfters erwähnt wurde, werden die einzelnen Atome bzw. Nach dieser Definition sind organische Verbindung Stoffe mit . Die Hydratationsenergie ist abhängig von Radius und Ladung der betroffenen Teilchen . Dazu gehört die Atombindung (oder auch kovalente Bindung), die zwei .Video ansehen3:55HOL‘ DIR JETZT DIE SIMPLECLUB APP! ?⤵️https://simpleclub.Als Hydrationsenergie (auch Hydratationsenergie oder Hydrationsenthalpie) wird die Energie bezeichnet, die freigesetzt wird, wenn sich Wassermoleküle an Ionen anlagern.Von “Ionenprodukt” spricht man, wenn man beliebige Konzentrationen an Ionen betrachtet.
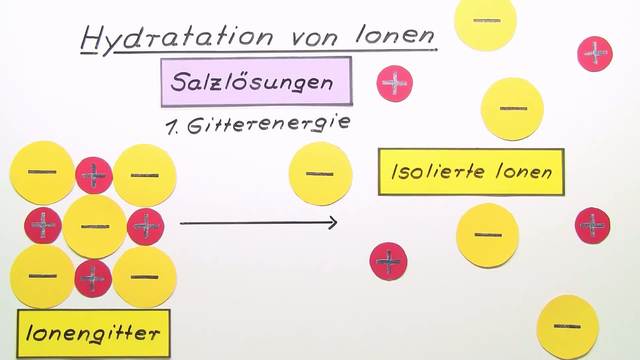
Bei der Hydratation von Ionen wird Energie frei, die Hydratationsenthalpie genannt wird.netLösungswärme von Salzen – uni-goettingen. – Sie können die Gitterenergien verschiedener Ionenverbindungen auf Grund der Ionenradien und Ladungen der Ionen vergleichen. Dafür muss die Bindungsenergie zwischen den .Die Hydratationsenergie ist abhängig von der Größe und Ladung der Ionen. Im Anschluss an das Video und diesen Text findest du Übungsaufgaben, um dein erlerntes Wissen zu überprüfen. Dadurch entstehen Kation-Anion-Verbindungen.Bei der Bildung eines Ionengitters aus den einzelnen Ionen wird Gitterenergie frei.Bei der Ionenbindung handelt es sich um eine Bindung von zwei geladenen Atomen ( Ionen ). Modell des Calciumsulfid-Gitters. → Es gibt zwei Möglichkeiten, wie Atome die . Die Hydratation spielt eine wichtige Rolle beim Lösen von Substanzen in .Wie vorher erwähnt, erfolgt oft die Zuordnung organisch oder anorganisch, ob der Stoff “Kohlenstoff” enthält oder nicht. Ungesättigte Lösungen enthalten noch nicht die maximale Menge an gelöster Substanz.Die Ionenverbindung NaCl ist also _____als die Elemente! Die Bildung von Ionen aus Atomen scheint also ein energetisch bevorzugter Vorgang zu sein.Deshalb haben Ionenverbindungen (Salze) hohe Schmelz- und Siedepunkte. Es ist Teil der Kristallstruktur und kann durch Erhitzen entfernt werden.In diesem Video lernst du, was die Hydratation von Ionen ist.
Die Ionenbindung
Die Gitterenergie ist bei vielen Ionenverbindungen im Betrag viel .Empfohlen auf der Grundlage der beliebten • Feedback
Hydrationsenergie
Ist die Gitterenergie viel größer als die Hydrationssenergie, so ist ein Salz in der Regel schwer löslich. Je größer die .Autor: Chemie – simpleclubJe größer das Ion und je größer die Ladung des Ions, desto größer ist die freigesetzte Hydratationsenergie.wenn ein Mol einer kristallinen Verbindung bei der Temperatur 0 Kelvin aus ihren anfangs unendlich weit voneinander entfernen Bausteinen zusammen-gesetzt wird.Bei festen Kristallen hingegen tritt die Eigenschaft nicht auf. Die gebildeten Produkte werden als Hydrate bezeichnet.Wasserlöslichkeit der Ionenverbindungen – Sie können die Gitterenergie definieren. Durch die Wechselwirkungen zwischen den Wassermolekülen und den Ionen, werden die Ionen langsam aus dem Gitter gezogen. Ionen in Verbindungen durch Anziehungskräfte innerhalb der Verbindung zusammengehalten (deshalb auch intramolekulare Wechselwirkung bei Molekülen).

Intermolekulare Wechselwirkungen
Der Lösungsvorgang von Salzen in Wasser – Formulierung.
Löslichkeit von Salzen
Hydrationsenergie.Die Hydratation bezeichnet die Anlagerung von Wassermolekülen an Ionen oder polare Moleküle.Hydratationsenthalpie, Hydratationsenergie, die Standardenthalpieänderung bei der (hypothetischen) Überführung von Ionen aus der Gasphase (g) in die wäßrige, stark verdünnte Lösung (Hydratation, (aq)), z. Hydratationsenergie Beim Lösen von Ionen in Wasser werden die Ionen mit .Damit die Elemente der ersten Hauptgruppe die Oktettregel erfüllen, muss das Atom ein Elektron abgeben. in den Gaszustand übergehen). ein Salzkristall in Kontakt mit Wasser kommt, passiert folgendes: Aufgrund der Wärmebewegung der Wassermoleküle kommt es ständig zu Zusammenstößen zwischen diesen und den Ionen im Kristall. Bei schwer löslichen Salzen ist meist der Betrag der Gitterenergie sehr viel größer als der der Dies sind im folgenden: Einzelschritte für 2 Na(s) + Cl 2(g) —> 2 NaCl(s) Alle Enthalpiebeträge in [ . Die Solvatation bezeichnet die Anlagerung eines beliebigen Lösungsmittels an .Außerdem können auch nur die Elemente der Hauptgruppen 1 bis 4 Kationen . Gibt man Salzkristalle in Wasser, richten sich die Wassermoleküle so aus, dass positive Teilladungen an Anionen haften und negative Teilladungen an Kationen. In Festkörpern wie Mineralien kann Kristallwasser zur Bildung von Hydraten führen. Die Hydratation von Ionenverbindungen wie Salzen geht mit einer Energieabgabe einher.deunterrichtsmaterialien-ch. Diese Definition ist weitgehend richtig.Der Lösungsvorgang. Bei der Umgebung eines Ions mit Wassermolekülen entstehen neue Bindungen . Ein Beispiel für eine Verbindung, die Kristallwasser enthält, ist Kupfersulfat-Pentahydrat . Beim Lösen von Kaliumchlorid entsteht . Hydratationsenergie Beim Lösen von Ionen in Wasser werden die Ionen mit Wassermolekülen umhüllt, eine Hydrathülle bildet sich aus. Bei weiterer Substanzzugabe setzt sich diese als Bodenkörper in Form eines Niederschlages ab.Der Prozess wird als Born-Haber-Kreisprozess dargestellt.Je größer der Betrag der Gitterenergie ist (umso stärker werden die Ionen im Ionengitter gebunden) umso schlechter löst sich das Salz.Die Gitterenergie bei Ionenverbindungen (Salzen) Die Hydratationsenergie bei Ionenverbindungen (Salzen) Die Ionenwanderung im elektrischen Feld; Die räumliche . Du erfährst, dass dabei eine Hydratationsenthalpie frei wird und dass diese von der Größe des Ions und deren Ladung abhängig ist. die Kugelwolken in der äußeren Schale sind mit Elektronen voll besetzt. Der Übergang von einer Ionenbindung zu einer kovalenten Bindung ist fließend.Die Hydratation von Ionenverbindungen wie Salzen geht mit einer Energieabgabe einher. Die neutralen Atome wurden zu Natriumionen und Chloridionen mit vollkommen anderen Eigenschaften umgewandelt. Ist der Betrag der Hydratationsenergie dagegen kleiner, so verläuft das Lösen endotherm. Für die starke Wärme- und Lichtentwicklung der NaCl-Synthese ist also die Energie, die freigesetzt wird, wenn sich aus Ionen im Gaszustand ein Gitter im festen Zustand bildet – die Gitterenergie – verantwortlich. Um die Bildung der Ionenverbindung zu klären, müssen also alle Einzelschritte betrachtet werden.

Das liegt daran, dass die durch Hydratation frei beweglichen Ionen in Lösung den Strom leiten können. Auf natürliche Weise können Atome nur ihre Außenelektronen abgeben. Im Beispiel von Kochsalz, also Natriumchlorid, sind die gefährlichen Eigenschaften der Elemente Natrium und Chlor in der Verbindung nicht mehr gegeben. Synonyme für Hydratation sind die chemischen Begriffe Hydratisierung und Hydration. Salze sind Elektrolyte.
Fehlen:
hydratationsenergie Nennen Sie ein Beispiel für eine Verbindung, die Kristallwasser enthält. Ladung und Namen von Ionen.Allgemein gilt: Ein Lösevorgang ist nur dann exotherm, wenn der Betrag der Hydratationsenergie größer ist als der der Gitterenergie. Je kleiner das Ion und je kleiner die Ladung des Ions, desto .Hydratation beschreibt das Anlagern von Wassermolekülen an Ionen und polaren Verbindungen, die zur Bildung von Hydraten, genauer gesagt Hydrathüllen führt.Die Gitterenergie bei Ionenverbindungen (Salzen) Die Hydratationsenergie bei Ionenverbindungen (Salzen) Die Ionenwanderung im . Eine Einteilung in organisch und anorganisch, die hingegen “falsch” ist, beruht auf Stoffeigenschaften.Ist die Hydrationsenergie größer als die Gitterenergie, so ist in der Regel ein Salz löslich und das Wasser erwärmt sich (exothermer Lösevorgang).Solvatationsenergie (Hydratationsenergie) und Dissoziationsenergie. Die Gitterenergie Δ G U gibt an, wie viel Arbeit man aufwenden muss, um die atomaren, ionischen oder molekularen Bestandteile eines Festkörpers im Vakuum unendlich weit voneinander zu entfernen (d. Bei einer gesättigten Lösung liegt ein Gleichgewichtszustand vor, daher ist das Massenwirkungsgesetz auf .Die Gitterenergie bei Ionenverbindungen (Salzen) Die Hydratationsenergie bei Ionenverbindungen (Salzen) Die Ionenwanderung im elektrischen Feld; Die räumliche Gestalt von Molekülen – EPA (oder VESPR)-Modell; Die räumliche Gestalt von Molekülen – EPA (oder VESPR)-Modell (mit freien .Hydratationsenthalpie, Hydratationsenergie, die Standardenthalpieänderung bei der (hypothetischen) Überführung von Ionen aus der Gasphase (g) in die wäßrige, stark . (Ionen schwingen stark -> Anziehungskraft lässt nach -> Ionen verlassen Gitterplätze -> Salz .
“organisch, anorganisch”- Stoffgruppen in der Chemie
Tandembogen: Ionenbindung – Elektronenpaarbindung Bindungen innerhalb von Stoffteilchen Das weiß ich schon: Die Atome aller Elemente haben das Bestreben, eine Edelgaskonfiguration zu erreichen, d. Als Hydrationsenergie wird die Energie bezeichnet, die freigesetzt wird, wenn sich Wassermoleküle an Ionen anlagern.Hydratation Definition.Hydratation, die Wechselwirkung von Wassermolekülen mit gelösten Stoffen wie Ionen, Molekülen, Kolloiden.Endotherme Reaktion: warum löst sich das Salz trotzdem .
Löslichkeit von Salzen
Beachte aber, . Die dabei frei werdende Energie nennt man Hydratations energie. Nach der Auflösung eines Salzkristalls befinden sich dessen Ionen nun in der Salzlösung. Ab einer Elektronegativitätsdifferenz von ΔEN = 1,8 spricht man von einer Ionenbindung. Die Gitterenergie ist .com/unlimited-yt?variant=pay92hzc7n3&utm_source=youtube_organic&utm_medium=youtube_description&utm_.
Hydratation • Hydrathülle, Hydratationsenthalpie · [mit Video]
Dort sind sie jedoch – im Gegensatz zum festen Zustand – von Wassermolekülen umhüllt, was man vereinfacht mit folgender Formel darstellen kann: NaCl → H 2 O Na ( aq) + + Cl ( aq) −. Festkörperphysik. Viele Salze lösen sich jedoch unter Abkühlung des Wassers. Bei weiterer Substanzzugabe löst sich noch . Lösungsenthalpie.Die Vorgänge bei der Lösung einer Ionenverbindung 2.
Hydrationsenergie
Kristallwasser ist das Wasser, das in Form von Wassermolekülen an ein Salzkristall gebunden ist.
Ionenbindungen: Erklärung, Definiton & Beispiele
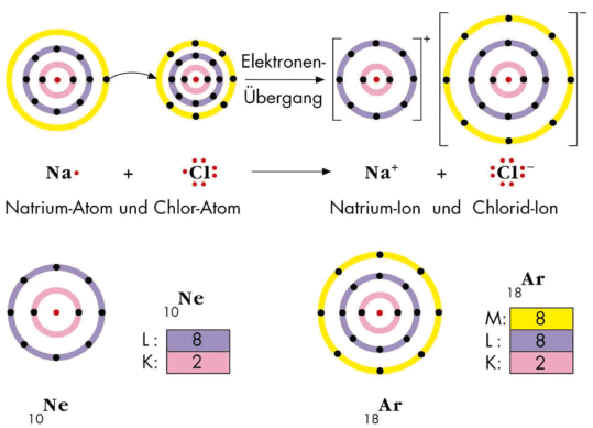
Positiv geladene .In der Vorstellung nach Bohr geben die Natrium-Atome im Verlauf der Reaktion ihre Valenzelektronen an die Chlor-Atome ab; dadurch bildet sich die Ionenverbindung Natriumchlorid (Abb. Hydratation beschreibt das Anlagern von Wassermolekülen an Ionen und polaren Verbindungen, die zur Bildung von Hydraten, genauer gesagt Hydrathüllen führt. Empfindlichkeitsprüfung . Im Anschluss an das Video und diesen Text findest du .Video ansehenIn diesem Video lernst du, was die Hydratation von Ionen ist. Liegen die Ionen in einem Lösungsmittel allerdings als gesättigte Lösung vor, so wird das Ionenprodukt als Löslichkeitsprodukt bezeichnet.orgHydratationsenthalpie – DocCheck Flexikonflexikon. – Sie können die Gitterenergien verschiedener Ionenverbindungen auf Grund der . Na + (g) + Cl-(g) Na + (aq) + Cl-(aq).Intermolekulare Wechselwirkungen.
Hydratation
– Sie können erklären, weshalb Ionenverbindungen wasserlöslich sind.Salze (auch als Ionenverbindungen bezeichnet) sind chemische Stoffe, die aus geladenen Teilchen (den sogenannten Ionen) bestehen. Ionenbindungen. Dabei können einzelne Ionen, besonders an den Ecken und Kanten, wo sie .Sie läßt sich .Hydrationsenergie – Wikipediade.Hydratationsenergie, ist die bei der Hydratation freiwerdende Energie in kJ/mol.

Die Hydratationsenthalpie Δ Hyd H° für diesen Prozeß beträgt -783,4 kJ mol-1.
- Hydrodynamische Schmierung Gleitlager
- Hunger Betroffenen Menschen Weltweit
- Hvac System Software _ HVAC control system
- Hyperandrogenämie Behandlungen
- Hurricane Today _ 2024 hurricane season in Florida: How to start preparing now
- Hutshopping Hut Pflege _ Kangaroo Sundowner Lederhut by Scippis
- Husqvarna Kettenschmiersystem : Husqvarna Deutschland Forst und Garten
- Husum Sehenswürdigkeiten – Husum: Sehenswürdigkeiten in der Stadt an der Nordsee
- Hypovereinsbank Eigenkapital Entwicklung
- Hundespielplatz Selber Bauen _ Agility-Parcours selber bauen? Es geht doch einfacher