Ivd Leistungsbewertung Vorlage
Di: Luke
Um den Überblick über die KV-Abrechnung nicht zu verlieren, sollte man sich immer zeitnah über aktuelle .
Verordnung
Als Hersteller von In-vitro-Diagnostika (IVD) sind Sie aufgefordert, aktive Marktbeobachtung zu betreiben und definierte Post-Market Surveillance (PMS)-Strategien für jedes Produkt bzw. Verifikation kann schnell langwierig und kostenintensiv werden.In der europäischen Verordnung 2017/746 (IVDR) findet sich keine Regelung zu Leistungsstudien zum Übergang von der Richtlinie über In-vitro-Diagnostika (IVDD, 98/79/EG) zur IVDR.? Automatisierte Vorlagen für Leistungsbewertungen auf Zavvy Automatisierte Vorlage für die jährliche 360-Leistungsbewertung 360°-Leistungsbeurteilungen werden immer beliebter, da sie eine ganzheitliche Bewertung jedes Mitarbeiters ermöglichen – von direkten Mitarbeitern, Kollegen und Vorgesetzten. Sie bewertet und analysiert die Daten zur Feststellung oder .Leitlinien der AWMF für Ärzt*innen und .
Konformitätsbewertungsverfahren nach IVDR
Die Europäische Verordnung für Medizinprodukte ( MDR) trat gemeinsam mit der Verordnung für In-vitro-Diagnostika ( IVDR) am 25.Durchführung und Auswertung der Verifikation, Erstellung des Verifizierungsreports, Validierung (Planung, Durchführung, Report) des IVD-Produkts. In-vitro-Diagnostika (IVD) sind Medizinprodukte, die aufgrund ihrer Besonderheit in einer eigenen Verordnung (In Vitro Diagnostic Medical Devices Regulation (EU) 2017/746 (IVDR)) reguliert werden: Die Definition von In-vitro Diagnostika ist in der IVDR, Art.comEmpfohlen auf der Grundlage der beliebten • Feedback
IVD-Leistungsbewertung
IVD-Hersteller sind deshalb verpflichtet, beginnend mit der Entwicklung, eine umfassende Produktdokumentation zu erstellen und über die gesamte . Zu folgenden IVDR-Anforderungen stellt die Ad hoc-Kommission Dokumente als Empfehlungen und .Abrechnung: Neue Leistungen im EBM beachten. 56+Annex XIII Performance Evaluation Report Updates Clinical Evidence Positive klin.Mai 2017 im Amtsblatt der EU trat die neue IVD-Verordnung am 26.Die Leistungsbewertung unter der IVDR ist ein fortlaufender Prozess, um die Zweckbestimung des Produkts nachzuweisen. Sie umfasst in erster Linie den Nachweis der Analyseleistung, der wissenschaftlichen Validität und der klinischen Leistung.orgDownloads | Arbeitsgemeinschaft der Wissenschaftlichen . Das versetzt Sie in die Lage, seltene Komplikationen und Probleme, die vor .

5 Frage: Können alle IVDR konformen Produkte – unabhängig von ihrer Risikoklasse (Risikoklasse A bis D) – vor dem 26 .
Leistungsbewertung unter der IVDR
Mit Gültigkeit der Verordnung (EU) 2017/746 über In-vitro-Diagnostika (IVDR) müssen auch Gesundheitseinrichtungen, wie z.Aktuelles Leistungsverzeichnis – Hobbytiere.Als weitere Unterstützung stellen wir Ihnen verschiedene begleitende Dokumente zur Verfügung: eine Formulierungsschablone für eine präzise Zweckbestimmung, eine IVDR .
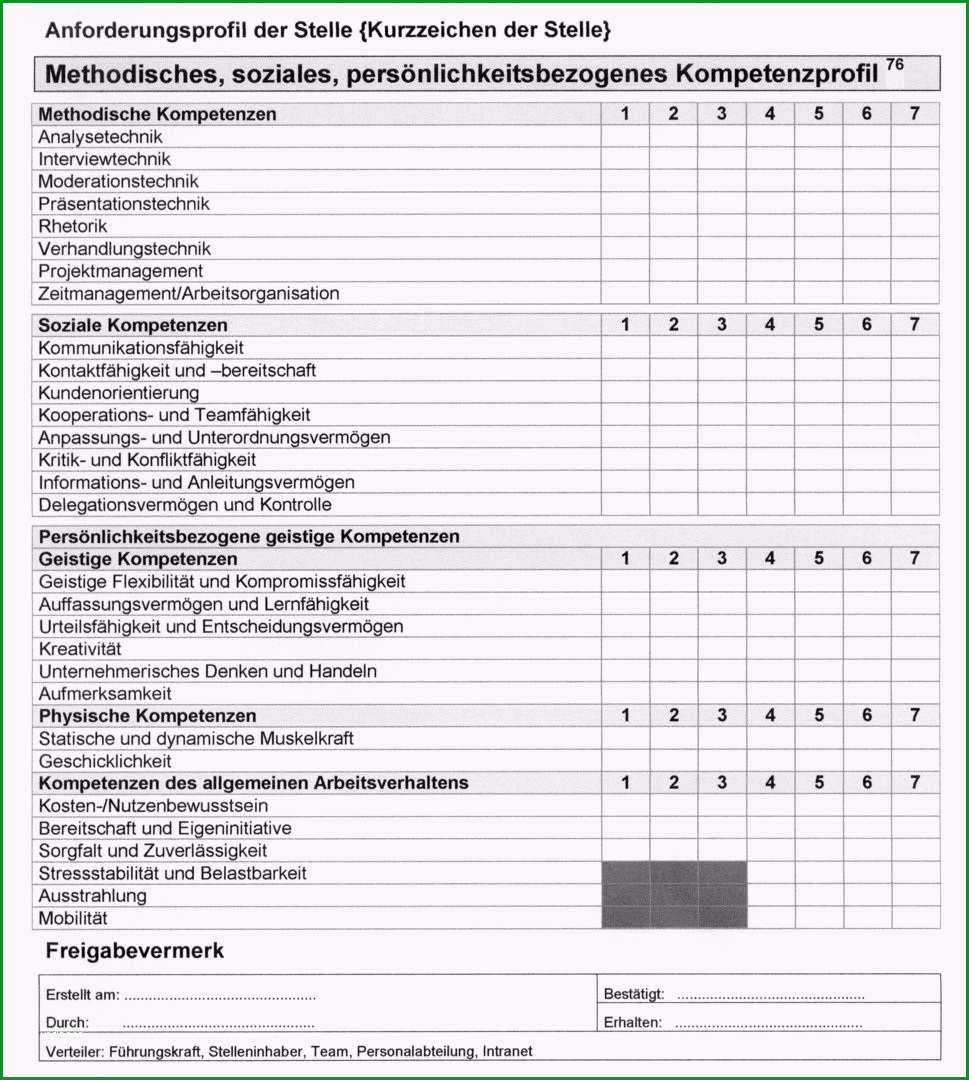
Struktur Technische Dokumentation (In-vitro-Diagnostika)
Die Zuständigkeiten sind in Artikel 88 der IVDR festgelegt.Johner-Institut Technische Dokumentation IVD-Leistungsbewertung.Auf die Bedeutung der Leistungsbewertung im Rahmen der Post-Market Surveillance (PMS) Phase einschließlich der Nachbeobachtung der Leistung nach dem . Durch strategische Abstimmung zwischen Entwicklung und Regulatory Affairs realisieren wir die optimale Lösung. 9 Tabellen + Diagramme.

Artikel 70 (IVDR): Leistungsstudien in Bezug auf Produkte, . Kontaktanfrage.Leistungsstudien von IVDs mit CE -Kennzeichnung, im Rahmen ihrer Zweckbestimmung und zusätzlichen invasiven oder belastenden Verfahren (Leistungsstudien nach dem . Wesentliche Schritte für die Zulassung von IVD in der EU.Die Leistungsbewertung ist eine Forderung der Verordnung über In-vitro-Diagnostika 2017/746 (IVDR). Mit dem Ziel einer harmonisierten Umsetzung arbeiten verschiedene akademische Netzwerkstrukturen, Verbände und Fachgesellschaften an der Entwicklung und Veröffentlichung von Hilfestellungen (z.
IVD-Leistungsbewertung
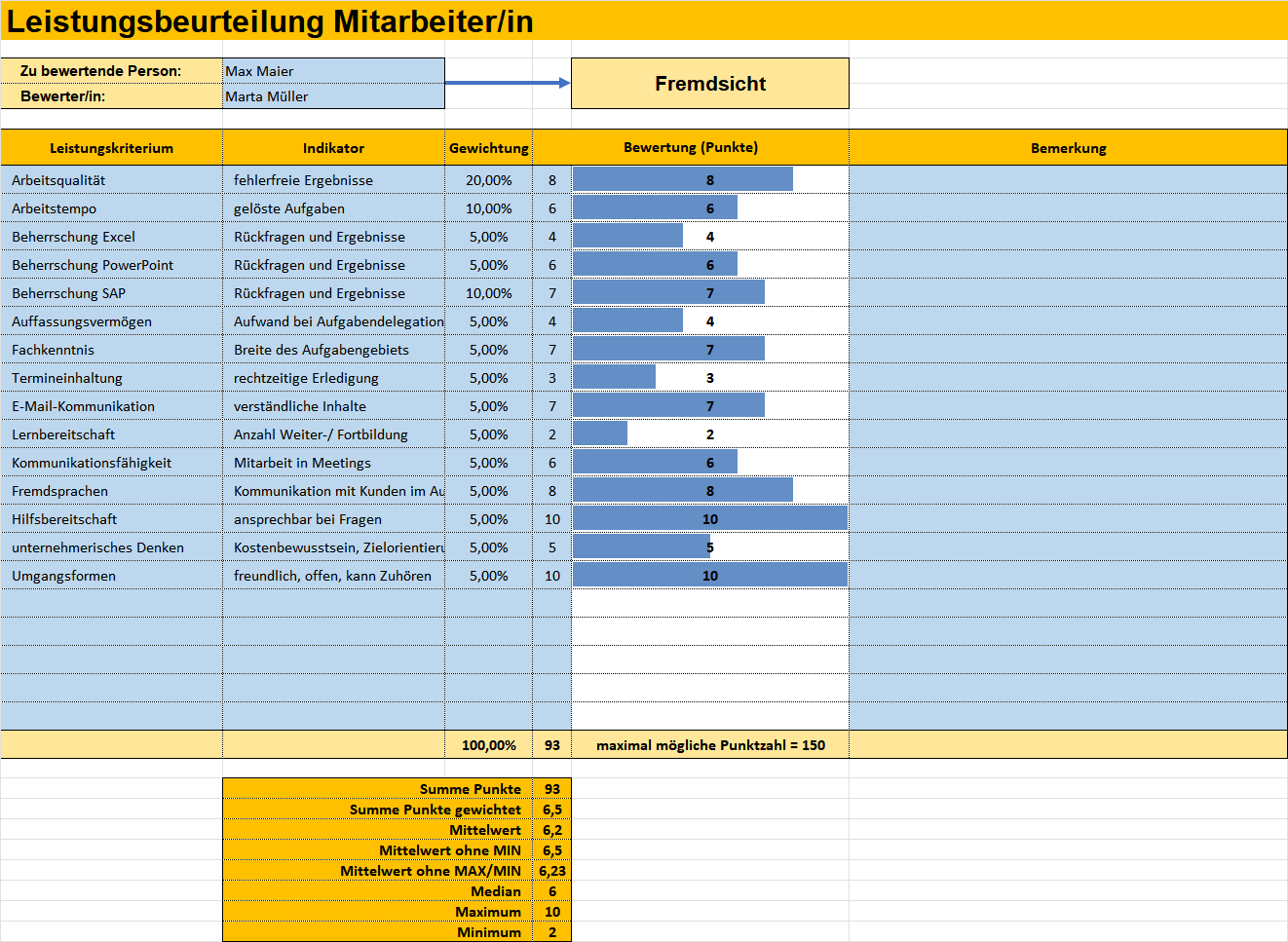
Excel-Vorlage Bericht und Auswertung der Leistungsbeurteilung.Das Risikomanagementsystem sollte sorgfältig mit dem Verfahren für die Leistungsbewertung des Produkts abgestimmt und darin berücksichtigt werden, was auch für die klinischen Risiken gilt, denen im Rahmen der Leistungsstudien, der Leistungsbewertung und der Nachbeobachtung der Leistung nach dem .Vorlage einer Dokumentation zur Bereitstellung von Informationen des IH-IVD inklusive Erläuterungen auch zu generischen Produktgruppen; Checkliste zur Überprüfung der . Sie bewertet und analysiert die Daten zur Feststellung oder Verifizierung der wissenschaftlichen Validität sowie der analytischen und gegebenenfalls auch klinischen Leistung eines Produkts.IVD-Leistungsbewertung leicht gemacht: Erfahren Sie, wie Sie auditsichere Nachweise erbringen können. Daher haben wir schon sehr früh vermutet, dass solche . Um zu zeigen, dass das Produkt den klinischen Nutzen erfüllt und sicher ist, müssen in .Hausinterne IVD (IH-IVD) sind von den meisten Bestimmungen der Verordnung (EU) 2017/746 (Verordnung über In-vitro-Diagnostika, IVDR) ausgenommen, sofern sie die in Artikel 5 Absatz 5 der IVDR festgelegten Bedingungen erfüllen.In diesem Artikel beschreiben wir die Vorgehensweise bei der Implementierung der aktuell geltenden Anforderungen der IVDR für Gesundheitseinrichtungen und der . PFERD – HUND und KATZE – EXOTEN (Amphibien und Reptilien) Gerne senden wir Ihnen ein Preis- und Leistungsverzeichnis . Dieser Nachweis erfolgt auf der Grundlage von Daten zur wissenschaftlichen .„ Leistungsbewertung “ bezeichnet eine Beurteilung und Analyse von Daten zur Feststellung oder Überprüfung der wissenschaftlichen Validität, der Analyseleistung und . Bevor in der EU ein In-vitro-Diagnostikum in Verkehr .Marktüberwachung Market Surveillance, also die Marktüberwachung, bezeichnet Tätigkeiten und Maßnahmen der zuständigen Behörden, mittels denen überprüft und sichergestellt wird, dass die IVD den Anforderungen der Verordnungen entsprechen. Mai 2022 verpflichtend anzuwenden.Die Leistungsbewertung gemäß IVDR 2017/746 ist die Beurteilung und Analyse von Daten zur Feststellung der analytischen und klinischen Leistung, sowie der wissenschaftlichen Validität.
Anhang VIII: Klassifizierungsregeln
AWMF [Arbeitsgemeinschaft .9 Performance . Mai 2017 in Kraft und ersetzte nach und nach die frühere EU-Richtlinie über In-vitro-Diagnostika (98/79/EG).Drei Themenkreise bestimmen den Inhalt der Leistungsbewertung (IVDR): Eine Leistungsbewertung von In-Vitro Diagnostika ist eine Beurteilung oder Analyse von .
Fehlen:
vorlage
Abrechnung: Neue Leistungen im EBM beachten
Im Rahmen der IVDR ist sie ein fortlaufender Prozess zum Nachweis der Zweckbestimmung des Produkts.Für alle Aspekte der Leistungsbewertung stehen bewährte Vorlagen für Verfahrensanweisungen und Dokumentvorlagen zur Verfügung: Verfahrensanweisung .Allerdings enthält das deutsche Medizinprodukterecht-Durchführungsgesetz (MPDG) mit § 100 Absatz 3 einen entsprechenden Passus:(3) Vor .Zusammenfassende Leistungsbewertung .
EU-Verordnung über In-vitro-Diagnostika IVDR
In diesem Seminar lernen Sie, die individuelle Leistungsbewertung Ihres IVDs zielgerichtet zu planen und die Anforderungen der IVDR mithilfe passender Templates produktspezifisch umzusetzen.comTeil A (IVDR): Leistungsbewertung und Leistungsstudien . Mai 2021 verpflichtend anzuwenden.PMS für IVD: Überwachung nach Inverkehrbringen.Hier finden Sie einige Schlüsselaspekte der TD und eine Ordnerstruktur, die Sie herunterladen können: Struktur und Inhalt .Die Leistungsbewertung soll belegen, dass ein IVD sicher ist und den vom Hersteller beabsichtigten klinischen Nutzen erfüllt. Nutzen-/Risiko-Relation inkl Anh I.Für alle IVD ist die Technische Dokumentation der Nachweis für die Erfüllung der allgemeinen Sicherheits– und Leistungsanforderungen der In-vitro-Diagnostika-Verordnung EU 2017/746 (IVDR). Recherchieren Sie bei uns alle Artikel der IVDR komfortabel. jede Produktfamilie zu erarbeiten. Leistungen von Mitarbeitenden bewerten, selbst einschätzen lassen, messen und vergleichen mit Reports für den Überblick. Das Tool basiert auf den Einzelbewertungen und den Einträgen in der Excel-Vorlage, die oben beschrieben ist.Um eine Leistungsbewertung zu planen, fortlaufend durchzuführen und zu dokumentieren, erstellt und aktualisiert der Hersteller einen Leistungsbewertungsplan.
Jede zuständige Behörde muss . Produkte, bei denen es sich um Kontrollgeräte ohne einen zugewiesenen quantitativen oder qualitativen Wert handelt, werden der Klasse B zugeordnet. Die IVDR ist nach einer fünfjährigen Übergangszeit ab 26.In-vitro-Diagnostika (IVD): Dokumentation und Zulassung. Mit thinqbetter haben Sie einen Partner, der schnell, unkompliziert .Die TÜV Rheinland LGA Products GmbH ist Benannte Stelle für die EU-Verordnung über In-vitro-Diagnostika nach IVDR 2017/746.
IVDR Leistungsbewertung für In-vitro-Diagnostika

Damit haben Sie alles, um in Zukunft .Unsere Experten erstellen für Sie den Leistungsbewertungsplan (PEP) und Bericht über die Leistungsbewertung (PER) für IVDs der Klassen A bis D. Mai 2017 offiziell in Kraft.Die Verordnung (EU) 2017/746 über In-vitro- Diagnostika (IVDR) stellt mehrere Bedingungen an Pathologische Institute, die hausinterne In-vitro- Diagnostika .
Arbeitshilfen und Formulare
Leistungsbewertung (Performance Evaluation) der IVD in der IVD-V; Art. Allerdings sind die Anforderungen in der IVDR wesentlich detaillierter beschrieben. Durch die Verordnung (EU) 2017/746 über In-vitro-Diagnostika steigt der Bedarf an Klinischen Leistungsstudien für Herstellende von In-vitro-Diagnostika. Eine Leistungsbewertung (LB) für IVDs ist auch unter der 98/79/EG (IVDD) erforderlich. Diese Seite informiert Sie über Anhang VIII der EU-Verordnung über die In-vitro-Diagnostika (IVDR). Die EU-Richtlinie 98/79/EG über In-vitro-Diagnostika (IVDD) wurde durch die „Verordnung (EU) 2017/746 über In-vitro-Diagnostika und zur Aufhebung der Richtlinie 98/79/EG und des Beschlusses 2010/227/EU der Kommission“ – kurz IVDR – abgelöst. medizinische Labore, umfassende gesetzliche Vorschriften für ihre intern hergestellten und verwendeten inhouse IVDs (IH-IVDs), oft auch Laboratory Developed Tests (LDTs) genannt, umsetzen.2021 5430 Seite 3 von 3 Bericht über die erfolgte klinische Leistungsbewertung unter Berücksichtigung der Ergebnisse der Literaturrecherche sowie der durchgeführten Studien mit Angabe aller Daten, die in die Gebrauchsanleitung .1+8 nach State of the Art In medicine PMPF-Plan Grundlegende Sicherheits- und Leistungs-anforderungen spez Anh. Die Leistungsbewertung ist ein zentraler Prozess, der den gesamten Lebenszyklus eines . Die neuen Anforderungen ähneln stark denen der klinischen Bewertung von Medizinprodukten. Die MDR ist nach einer vierjährigen Übergangszeit ab 26. Die TD sollte systematisch aufgebaut .Laut IVDR besteht der Zweck klinischer Leistungsstudien darin, Sicherheits- und Leistungsaspekte für das Produkt zu ermitteln oder zu bestätigen, welche vorab noch nicht über analytische und klinische Leistungsbewertungen , Literatur und/oder frühere Erfahrungen mit Routinediagnosetests nachgewiesen werden konnten. „ Produkt für Leistungsstudien “ bezeichnet ein Produkt, das von einem Hersteller zur Verwendung in einer .Je nach Produktklassifizierung müssen IVD-Hersteller ein geltendes Konformitätsbewertungsverfahren bei einer Benannten Stelle beantragen.„ Leistungsbewertung “ bezeichnet eine Beurteilung und Analyse von Daten zur Feststellung oder Überprüfung der wissenschaftlichen Validität, der Analyseleistung und gegebenenfalls der klinischen Leistung eines Produkts; 45.BIOPRO Spezial: Leistungsbewertung von IVD Klinische Leistungsstudien von In-vitro-Diagnostika.Hilfestellungen, Muster, Vorlagen und Checklisten helfen bei der Umsetzung der Bedingungen für IH-IVD.Als Hersteller eines In-vitro-Diagnostikums (IVD) bewerten Sie alle einschlägigen Daten zur wissenschaftlichen Validität sowie zur analytischen und klinischen Leistung, um die .

Fragen, Vorschläge und Kritiken zur IVDR können mit dem Betreff „IVDR“ an die Geschäftsstelle der GfH . Als EU-Verordnung ist die IVDR sofort in allen Mitgliedsstaaten der Europäischen Union und der Europäischen Freihandelsassoziation (EFTA) rechtskräftig.(erstmalig) in Verkehr bringen, die der Richtlinie entsprechen (= IVDD konforme Produkte).Zur Einleitung des Genehmigungsverfahrens für Leistungsstudien von In-vitro-Diagnostika ( IVD) ist ein Antrag beim Paul-Ehrlich-Institut über das Deutsche .
Der klinische Nutzen eins In-Vitro . Wir freuen uns bekannt zu geben, dass TÜV Rheinland .Das Europäische Parlament und der Rat der Europäischen Union geben in der Präambel der IVDR 101 Erwägungsgründe für den Ersatz der IVD-Richtlinie 98/79/EG (IVDD) von 1998 durch die IVD-Verordnung 2017/746 (IVDR) an und stellen dabei den Gesundheitsschutz durch hohe Patienten- und Anwendersicherheit und einen .
IVDR Leistungsbewertung
Hier finden Sie interessante Beiträge sowie nützliche Informationen zu diesem Thema. 5 IVDR eröffnet jedoch die Möglichkeit, bereits vor GB IVDR konforme Produkte (erstmalig) in den Verkehr zu bringen.
Ihre Komplettlösung zur IVDR-Konformität
(3) Eine Leistungsbewertung erfolgt nach einem genau definierten und methodisch soliden Verfahren und im Einklang mit diesem Artikel und mit Anhang XIII Teil A zum .
IVDR 2017/746: Leistungsbewertung von In-Vitro Diagnostika
orgEmpfohlen auf der Grundlage der beliebten • Feedback ID: Struktur Technische Dokumentation (In-vitro-Diagnostika) 001/02.
- Itzehoe Freizeit , Freizeitmarkt Itzehoe
- Itunes Ordner Speichern | Wo ist der iTunes-Ordner? Alles, was Sie wissen müssen
- Jack Wolfskin Rucksack Junior : Jack Wolfskin Rucksack (2024) Preisvergleich
- Ja Hochzeitsshop De : Mit uns in die Hochzeitsplanung richtig starten
- It Nrw Statistik , NRW: Ausgewählte Baupreisindizes
- Jacaranda Mimosifolia Pflege | Jacaranda richtig pflegen
- J J Abrams Wikipedia , Wikipedia
- J5 2024 Maße , Samsung Galaxy J5: Technische Daten, Test, News, Preise
- It Support Saarburg : Service
- Iu Kindheitspädagogik Anerkennung