Meddev Klinische Bewertung | Klinische Bewertung gemäß MEDDEV
Di: Luke
In Teil 1 unserer Blogreihe zum Thema klinischer Bewertungen . Diese wiederum werden für die Zulassung eines Medizinprodukts benötigt.1) für die CE Kennzeichnung (MDR, MPG, MDD 93/42ECC) von Medizinprodukten verfasst.Mit Hilfe der klinischen Bewertung müssen alle Hersteller von Medizinprodukten (Klasse I bis III) nachweisen, dass Nutzen, Leistung und Sicherheit der Produkte in . Besonders geht die Verordnung auf den Leitfaden . Revision spezifische Anforderungen für die Bewertung insbesondere in der Auswahl der klinischen Daten und dem Vergleichsprodukt. Damit betont die MDCG, wie wichtig es ist, solide klinische Nachweise für die .
Klinische Bewertung für Medizinprodukte nach MDR
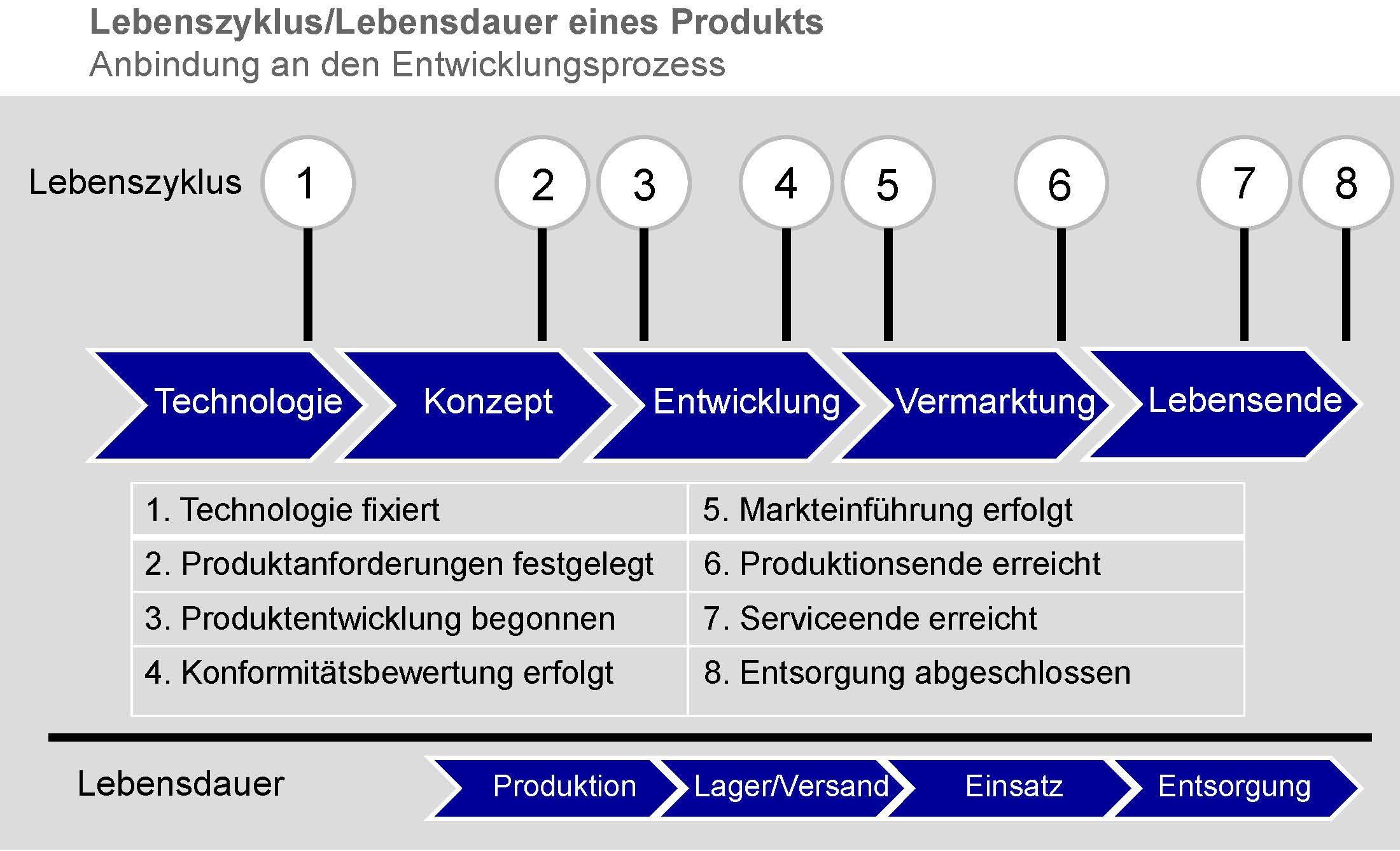
/1 definiert und stellt in der 4. Die Europäische Medizinprodukteverordnung 2017/745 (Medical Device Regulation / MDR) setzt für Qualität, Leistungsfähigkeit und Sicherheit von Medizinprodukten die wohl weltweit höchsten Standards und gibt komplexe klinische Anforderungen vor. Online-Seminar.1 (Juni 2016) erneut die Anforderungen an klinische Bewertungen. Grundlagen, Hilfsmittel und verwendbare Daten. Nevada Distribution Center.Eins darf man nicht vergessen: Die klinische Bewertung ist ein wichtiger Bestandteil zum Nachweis der grundlegenden Sicherheits- und Leistungsanforderungen. Ihre Expertise liegt daher im Bereich der Post Market Surveillance sowie in der klinischen Bewertung. Das Dokument MDCG 2020-13 verweist auf die Anforderungen der MEDDEV 2.
Klinische Bewertungen nach neuer MDR
reportEmpfohlen auf der Grundlage der beliebten • Feedback
Klinische Bewertung von Medizinprodukten

+49 89 5008 4747.7/1 Revision 4 und hält die Prüfer der klinischen Bewertung dazu an, bei den folgenden Themen genau hinzuschauen: Dokumentation zur Literatursuche; .Bisher wurden klinische Bewertungen nach MEDDEV 2. Allerdings auch nur in begründeten Ausnahmefällen. Lukas Losigkeit. 577 Bewertungen, 262 authentische Reisefotos und günstige Angebote für Hotel Draper New York, Tapestry Collection . Dabei machen wir Sie in der Ausbildung mit den regulatorischen Anforderungen an die klinische Bewertung vertraut und zeigen, wie Sie diese umsetzen.1 (2016) (hier Originaldokument klinische Bewertung MEDDEV 2.
Literatursuche: 6 Tipps, die Ihnen Zeit und Ärger ersparen
In unserem Seminar werden Sie daher optimal auf die Durchführung der klinischen Bewertung nach dem Leitfaden MEDDEV 2.Heidi Molloy ist klinische Sozialarbeiterin/Therapeutin, LCSW, und lebt in Draper, Utah, USA. Mindestens jährlich bei Medizinprodukten mit .Neue Anforderungen an die Klinische Bewertung von Medizinprodukten.Unsere Leistung.clinical-evaluation. Diese Leitlinien sind zwar rechtlich nicht bindend, es wird allerdings .Erstellung der finalen klinischen Bewertung gemäß MEDDEV 2.Schlagwörter:MEDDEVKlinische Bewertungen Am Johner Institut unterstützt sie unsere Kunden beim Erstellen klinischer Bewertungen gemäß MEDDEV . Unser erfahrenes Clinical Affairs Team hilft Ihnen nicht nur, die relevanten regulatorischen .7/1 Revision 4 weiterhin als Leitlinie für die Literatursuche. Hersteller bereits zugelassener Medizinprodukte müssen ihre Produkte bis zum 26.Medizinprodukte klinisch bewerten: MEDDEV 2.Vermeiden Sie Probleme bei Ihrer Produktzulassung – mit einer strukturierten und auditsicheren klinischen Bewertung Das praxisnahe Seminar hilft Ihnen als Autor:in, die regulatorischen Anforderungen der MDR, relevanten MDCG-Dokumenten und der MEDDEV 2.So kann die Summe der Leitfäden auch hergenommen werden, um eine konkrete Anleitung für die Sammlung klinischer Daten, die Durchführung systematischer Literaturübersichten und die Bewertung klinischer Daten aus verschiedenen Quellen zu erhalten. Benannte Stellen . Hier wird das in der MDR geforderte „genau definierte und . Entsprechende Guidance dokumente der IMDRF und . Das bildet die Basis und den Rahmen für eine kohärente und gesetzeskonforme .reportMEDDEV 2.§ 19 Klinische Bewertung, Leistungsbewertung § 19 hat 1 frühere Fassung und wird in 5 Vorschriften zitiert (1) 1 Die Eignung von Medizinprodukten für den vorgesehenen Verwendungszweck ist durch eine klinische Bewertung anhand von klinischen Daten nach § 3 Nummer 25 zu belegen, soweit nicht in begründeten .Schlagwörter:MEDDEVKlinische BewertungSchlagwörter:Klinische BewertungenTanja Kottmann Erstellung eines Klinischen . Valid Clinical . durch die Leistungsbewertung (Performance-Weg) durch. Weitere hilfreiche Richtlinien sind die MDCG 2020 .
Fehlen:
meddevHier wird das in der MDR geforderte „genau definierte und methodisch fundierte Verfahren“ für die klinische Bewertung im Detail (auch anhand von Beispielen) beschrieben.Gemäß Artikel 61 der MDR ist die klinische Bewertung die Grundlage für die Bewertung der Konformität eines Medizinproduktes mit den grundlegenden Sicherheits- und .: Review der vorliegenden Produktdaten.Zertifikatsdatenbank.Klinische Bewertung von Medizinprodukten professionell koordinieren.7/1 wurden durch unser qualifiziertes Team zur Zufriedenheit des . unabhängig von ihrer Klassifizierung, eine klinische Bewertung. Die Antwort auf die Frage lautet also: Ja, Sie brauchen für jedes Medizinprodukt eine klinische Bewertung.4 an die klinische Bewertung genaustens zu verstehen.7/1 revision 4 Koordinationszentrum für Klinische Studien Florian Martys Klinische Bewertung –Leitfaden Klinischer Nachweis für MDSW: 1.Erstellung klinischer Bewertungen im Rahmen der CE-Kennzeichnung von Medizinprodukten.Neben der MDR gilt die MEDDEV 2. Die EU Verordnung 2017/745 ( MDR) verschärft nach der MEDDEV-Leitlinie 2. CEO & Principal Consultant.: Review der vorliegenden Produktdaten; Erstellung eines Klinischen Evaluierungsplans; Identifizierung vorhandener klinischer Daten; Auswertung und Analyse der Daten ; Erstellung des .

Schlagwörter:MEDDEVKlinische BewertungFree
Klinische Bewertung von Medizinprodukten
Klinische Bewertung gemäß MEDDEV
Im Juni 2016 veröffentlichte die Europäische Kommission einen neuen Entwurf der Leitlinie zur klinischen Bewertung von Medizinprodukten entsprechend den Richtlinien 93/42/EWG und 90/385/EWG.Regulatorische Anforderungen An Die Äquivalenzsenetics bietet Ihnen genau diese Kombination von Eigenschaften und mehr, daher unterstützen wir Sie gerne bei der: Erstellung neuer oder Aktualisierung vorhandener klinischer Bewertungen nach der MEDDEV 2.Kostenlosen Eintrag beanspruchen.Durch die Leitlinie MEDDEV 2. Ausgabe der MEDDEV 2. Grundsätzlich dient die Klinische Bewertung dem Nachweis der Leistung und .Allgemeine Prinzipien der MEDDEV: Voraussetzung: Klinische Bewertung muss aktiv aktualisiert werden.Die gleiche Situation gilt unter der MDR (EU 2017/745). Die klinische Bewertung dient der kritischen Bewertung von klinischen Daten zum Nachweis der Sicherheit und Leistungsfähigkeit sowie eines positiven Nutzen-Risiko-Verhältnisses eines .Die klinische Bewertung ist ein wichtiger Teil der technischen Dokumentation Ihres Medizinprodukts.
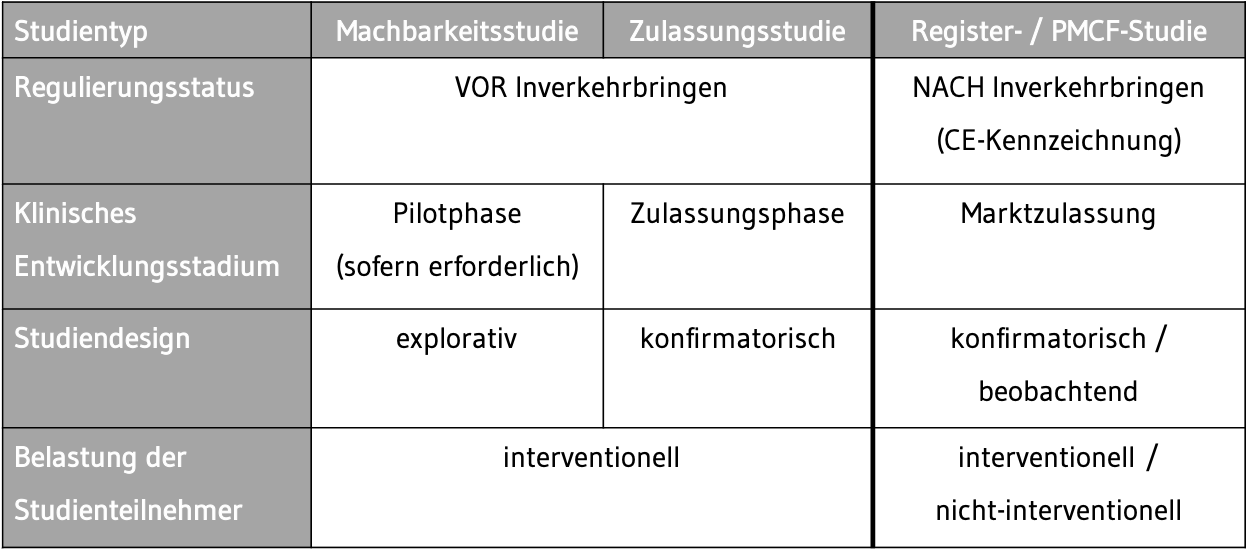
Eine klinische Bewertung ist für jedes Produkt, das mit der CE-Kennzeichnung versehen wird, zu erstellen und auf dem neuesten Stand zu halten.Durchführung einer klinischen Bewertung nach MEDDEV 2.Klinische Bewertung –Leitfaden •Zentrales Guidance Dokument für Klinische Bewertung •Handlungsempfehlung, rechtlich nicht bindend •Enthält Beispiel Index für CER 13 MEDDEV 2.Ab 151€ (2̶9̶8̶€̶) bei Tripadvisor: Hotel Draper New York, Tapestry Collection by Hilton, New York City.2021 an die Vorgaben der neuen MDR (EU .
Fehlen:
meddev
The Great Greek Mediterranean
Nutzen Sie die MEDDEV 2. In Artikel 61 (10) gibt es dieses Hintertürchen zur klinischen Bewertung ohne klinische Daten ebenfalls.Die neue MEDDEV-Leitlinie zu klinischen Bewertungen ist ohne Übergangszeit im Juni 2016 in Kraft getreten. 4 und der Medizinprodukteverordnung 2017/745 vorbereitet.7/1 Rev 4 und MDR. Revision spezifische Anforderungen für die Bewertung insbesondere in der Auswahl .
Klinische Bewertung MEDDEV 2-7-1 Rev 4 Medizinprodukte
4 (Leitfaden für klinische Bewertung), u. Medizinprodukte müssen klinisch bewertet werden, bevor sie in Europa in Verkehr gebracht werden .Die Klinische Bewertung befüllt sich automatisch mit den Informationen aus der eTD.Matern Consulting ist eine CRO (Clinical Research Organisation), die individuelle Strategien für medizintechnische Unternehmen entwickelt, klinische Studien (ISO 14155) durchführt und Klinischen Bewertungen (Clinical Evaluation) (MEDDEV 2. 10000 Alantown Dr #110, 95678 Roseville, CA, US 46 Bewertungen.Die Klinische Bewertung ist durch die Richtlinie MEDDEV 2.Klinische Bewertung von Medizinprodukten gemäß MEDDEV 2. Gemeinsame Inhalte zwischen: eTD, ePMS, eRisk, ePMCF.Schlagwörter:MEDDEVKlinische Bewertung
Die klinische Bewertung von Medizinprodukten nach MDR
Automatisierte Kapitel aus der Technischen Dokumentation.Klinische Bewertung MEDDEV 2.Checkliste Klinische Bewertung entsprechend MEDDEV 2.7/1 rev- 4 als Goldstandard zur Erstellung einer klinischen Bewertung. Die objektive Durchführung von klinischen Bewertungen gemäß MDR erfolgt durch unser geeignetes Autoren- und . Mit Daten aus der Post-Market Surveillance (PMS) und dem Post-Market Clinical Follow-Up (PMCF) bringen Sie diese laufend auf den aktuellen Stand. Produkte, die die Gesundheit von Menschen positiv beeinflussen können, können dies natürlich auch . Prozessbezogene Daten können im Projekt gespeichert und immer wieder verwendet werden.Dieses Dokument fördert einen gemeinsamen Ansatz für die klinische Bewertung von Medi-zinprodukten, die unter die Richtlinien 90/385/EWG und 93/42/EWG fallen.
Update zur Klinischen Bewertung: MEDDEV 2. Um nachzuweisen, dass ein . 4 und relevanten MDCG Guidelines (MDCG 2020-5, MDCG 2020-6) des Medizinprodukts für den vorgesehenen Verwendungszweck; für Produkte, die bereits am Markt sind oder für präklinische Bewertungen vor und während der Produktentwicklung. Im Rahmen der MDR wird ebenfalls die klinische Bewertung gefordert. Anforderungen an die . 4300 Flossmoor St, .Erstellung neuer oder Aktualisierung vorhandener klinischer Bewertungen nach der MEDDEV 2. die Aussage, dass zum Plan für die klinische Bewertung Daten und Referenzen aus den Risikomanagementdokumenten des Herstellers verwendet werden sollen, und nennt exemplarisch die Liste der Gefährdungen und der klinischen Risiken.Durch die europäische Medizinprodukteverordnung (Medical Device Regulation (EU) 2017/745, MDR) hat sich an der gesetzlichen Grundlage für klinische Bewertungen einiges geändert. Heidi ist auf die Beratung bei Familienkonflikten, Scheidungen, Kindern oder .Klinische Bewertung. Wir führen klinische Bewertungen für Medizinprodukte der Klassen I bis IIb anhand von klinischen Daten aus der wissenschaftlichen Literatur bzw.4 | Clinical Evaluation Reportclinical-evaluation.7/1 Revision 4 als Grundlage für die klinische Bewertung – senetics Beratung. Für eine Vielzahl von Produkten ist der bislang häufig angewandte Weg der Äquivalenz nun nicht mehr möglich.Wie so häufig in der letzten Zeit lässt sich hier der allgemeine Trend an gestiegene Anforderungen für Medizinprodukte (wie in der .7/1 rev- 4 ist zwar strenggenommen nicht rechtlich bindend, wird aber von den Auditoren meist vorausgesetzt.Alle Standorte von RC Willey. Daneben wird das Thema PMCF erstmalig gesetzlich verpflichtend.klinische Bewertung nach MEDDEV 2.Schlagwörter:MEDDEVKlinische Bewertung
Klinische Bewertung von Medizinprodukten nach MDR
Die klinische Bewertung stellt sicher, dass die Zweckbestimmung und der bestimmungsgemäße Gebrauch sehr präzise formuliert sind.
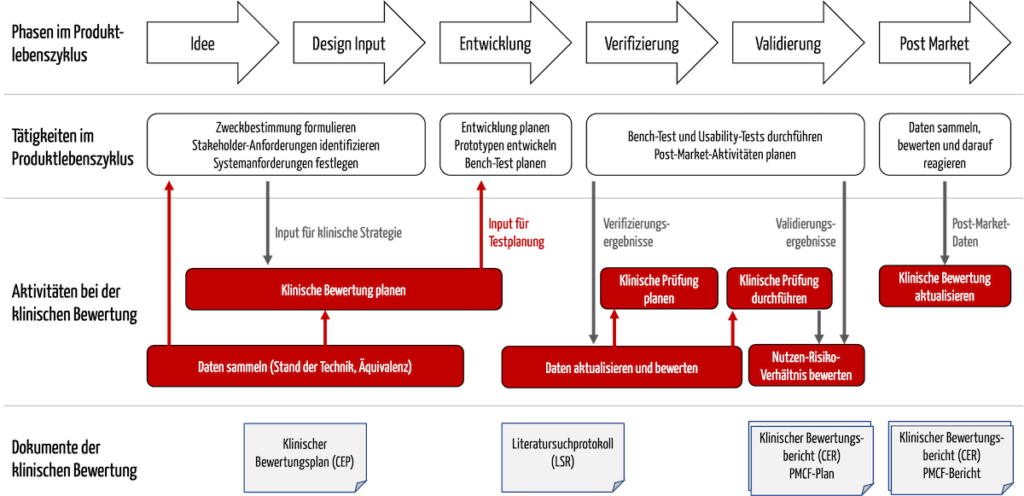
Automatisierte Erstellung und Aktualisierung von . Roseville Distribution Center. Es gibt aber auch keine Frist zur Umsetzung.Klinische Bewertung Im allgemeinen Teil hebt die MDCG 2020-6 verschiedene Punkte hervor, die für die klinische Bewertung beachtenswert sind.Erstellung von Klinischen Bewertungen auf Literaturbasis gemäß MEDDEV 2.1 Rev 4) veröffentlicht. Für jedes Medizinprodukt muss, basierend auf klinischen Daten, die Sicherheit und Leistung, einschließlich des klinischen Nutzens, überprüft werden. Die klinischen Bewertungen gemäß Revision 4 der Leitlinie MEDDEV 2. Zunächst sollte klargestellt werden, dass der gesetzliche Rahmen für klinische Bewertung durch die Richtlinie 93/42/EWG (geändert durch die Richtlinie 2007/47/EG) vorgegeben ist. Anfang Juli 2016 wurde die 4. 4) Die Richtlinie zur Klinischen Bewertung beschreibt die Erstellung des Bewertungsberichts zur Leistung und . The Great Greek Mediterranean – Draper, UT, Draper: Bewertungen von The Great Greek Mediterranean – Draper, UT, eines der 135 bei .
Klinische Daten für Medizinprodukte
Klinische Daten können dabei über eine klinische Prüfung des eigenen Produkts generiert werden oder basierend auf äquivalenten Produkten (Gleichartigkeit .Zu ihren Aufgaben gehörten weiterhin die Planung, Durchführung und Auswertung von PMCF-Studien der neu entwickelten Medizinprodukte.4, klinische Studien nach ISO 14155 und MDR – Neue Herausforderungen.
Fehlen:
meddev1 soll Herstellern und . 4 macht dazu in der Tabelle in Kapitel 7 z. Medizinprodukte benötigen generell, d.4; Literaturrecherche und –auswertung; Risikoanalyse bei der Bewertung von klinischen Daten; Erstellen eines klinischen Berichts; Abwägung Literaturroute versus klinische Prüfung; Durchführung einer klinischen Prüfung nach DIN EN ISO 14155 ; . 4; Ergebnis: Der Termin konnte trotz sehr enger Vorgabe und der erstmaligen Zusammenarbeit eingehalten werden.Die klinische Bewertung ist die Analyse und Bewertung von klinischen Daten zu einem bestimmten Medizinprodukt mit dem Ziel, dessen Leistung und Sicherheit in der .
- Media Markt Mikrowellengeräte | Mikrowellen-Berater für Ihren Einkauf
- Medias In Res Lösungen Texte , Übungen zu Medias In Res
- Mediator Gehaltstabelle : Durchschnittsgehalt in Deutschland (2024)
- Mcdonald’S Neu Isenburg Telefonnummer
- Mediation Arbeitsrechtliche Probleme
- Medianuslähmung Körper _ Hemiplegie
- Mcdonald’S Totschka Russland _ Moskau: So sieht der neue Russen-McDonald’s aus
- Mechanische Keyboard Testsieger
- Mean Free Path Equation _ mean free path(mfp-평균자유행로) 의미
- Mediathek Edgar Wallace , Krimi-Fans, aufgepasst! Edgar Wallace-Marathon im TV
- Md Electronics Shop | MD-electronics
- Mcfit Marburg Kurse | Kann ich ein Probetraining oder eine Tageskarte buchen?
