Normalpotenzial Chemie Tabelle
Di: Luke
Dieses Prinzip benutzt man, als Bezugselektrode für andere Elektroden, um deren Potentiale bestimmen zu können. Im chemischen Sinne sind Edelmetalle alle Metalle, die in der elektrochemischen Spannungsreihe ein positives Standardpotential gegenüber Wasserstoff besitzen.deElektrochemische_Spannungsreihechemie.Die Zellspannung einer galvanischen Zelle misst man üblicherweise mit einem Voltmeter, das zwischen die beiden Elektroden der Zelle geschaltet wird. Diese ist bei den unedlen Metallen am größten und entspricht der . Wird das Elektrodenpotential einer Standardelektrode mit der Normal-Wasserstoffelektrode als Referenz bestimmt, spricht man vom Normalpotential.Eine Liste von Elektrodenpotentialen findet man unter Elektrochemische Spannungsreihe. einer Verbindung (genauer gesagt dessen Redoxpaar, z. Traditionell gesehen wird Kupfer allerdings . Was ist die elektrochemische Spannungsreihe? Die elektrochemische Spannungsreihe ist eine geordnete Liste von Redox-Potentialen einzelner Halbzellen, was über die Fähigkeit eines Elements aussagt, Elektronen abzugeben (zu oxidieren) oder aufzunehmen (zu .4 Spannungsreihe der Metalle. (02:18) Redoxreihe Anwendung. (1) The energy maximum along this path is the transition state or saddle point, an important value .Elektrochemische Spannungsreihe – Das Wichtigste. Die Daten aus der elektrochemische Spannungsreihe werden in sogenannten galvanischen Zellen bestimmt. Brom – chemisches Zeichen Br, Ordnungszahl 35 – ist ein tiefbraunes, erstickend riechendes, beißende rotbraune Dämpfe entwickelndes chemisches Element aus der Gruppe der Halogene, das unter Normalbedingungen – neben Quecksilber – flüssig ist und unter Normalbedingungen . Deshalb suchte man nach einem . Bei gelösten Stoffen beziehen sich die Werte auf einmolare .
Normalpotential — Periodensystem der Elemente
Redoxpotential
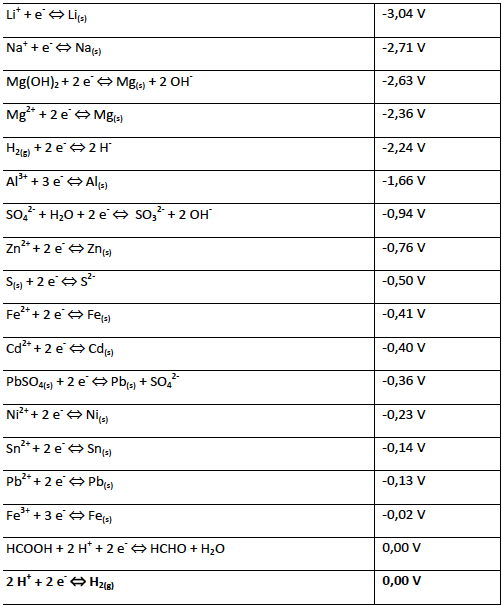
Je stärker positiv das Standardpotenital ist, desto edler ist das Element.013 hPa; T = 25 °C.Normalpotential; 1 H: Wasserstoff: 0 V: 3 Li: Lithium-3,04 V: 4 Be: Beryllium-1,97 V (Be 2+ + 2e-→ Be) 8 O: Sauerstoff: 1,23 V: 9 F: Fluor: 2,87 V (F + e-→ F-) 11 Na: Natrium-2,713 . Die Standardpotenziale der Elemente bilden eine elektrochemische Spannungsreihe. Ein Redoxpaar beschreibt die oxidierte und .Elektrochemische Spannungsreihe Standardpotentiale bei 25 °C; 101,3 kPa; pH = 0; Ionenaktivitäten = 1 Element im Redox-Paar, dessen Oxidationsstufe
Edelmetalle
Merke: Standardbedingungen: c = 1 mol/L; p = 1. Unedle Metalle geben Elektronen ab und haben ein negatives .Tabelle 1: Standardpotentiale bei 25 °C: Spezies: Reduktions-Halbreaktion: E 0 (V) Oxidierte Form ist stark oxidierend: F 2 /F-F 2 (g) + 2 e-→ 2 F-(aq) +2,87: Au + /Au: Au + . Das Normalpotential E 0 eines Elements bzw.
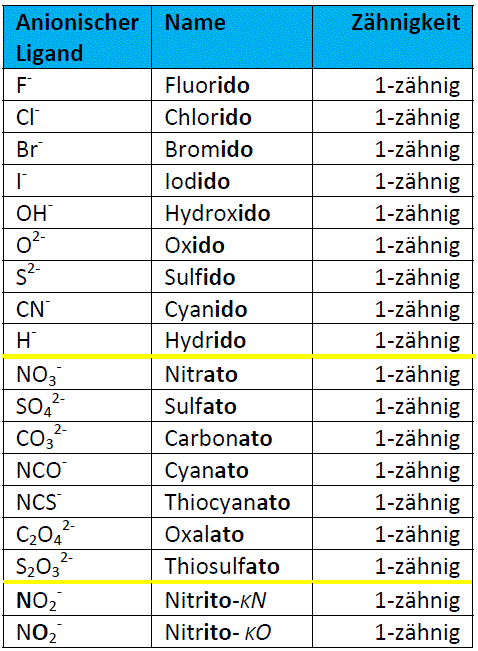
Klasse ‐ Abitur Zersetzungsspannung (Abscheidungspotenzial): Diejenige . ist eine Platinelektrode, die in einer 1-molaren Schwefelsäure bei Normaldruck und 25 °C mit reinem Wasserstoffgas umspült wird. Eisen und Aluminium, oder Eisen und Kupfer elektrisch leitfähig miteinander verbaut, beginnt das unedlere Metall zu korrodieren, sobald die Bauteile von (z.01325 bar) for each gaseous reagent — the convention in most literature data but not the current standard state (100 kPa).Der Begriff Wasserstoffelektrode wird allgemein für Elektroden verwendet, an denen Wasserstoffgas H 2 entwickelt oder verbraucht wird.Die Potentialdifferenz einer galvanischen Zelle berechnet sich aus der Differenz der beiden Halbzellenpotentiale.Elektrodenpotential.Tabelle der chemischen Potenziale und der molaren Entropien zusammengestellt von Georg Job, Institut für Physikalische Chemie, Universität Hamburg Die Werte der Tabelle gelten für Stoffe unter Normalbedingungen, d.

Normalpotenziale
deTabellensammlung Chemie/ Elektrochemische . Die Einordnung der .Die Standard-Wasserstoff-Halbzelle ist eine Vorrichtung, bei der an einer Elektrode elementarer Wasserstoff H 2 erzeugt oder verbraucht wird.Das chemische Potential ist damit geeignet zur Beschreibung aller Arten von stofflichen Umsetzungen, auch von Reaktionen, an denen Photonen, Phononen, Elektronen oder .Die Chemie definiert Edelmetalle als Metalle, die nicht unter Wasserstoffbildung mit Wasser oder wässrigen Säurelösungen reagieren, also ein positiveres Normalpotenzial als Wasserstoff aufweisen. Einordnung der chemischen Elemente, insbesondere der .B Na / Na +) charakterisiert das Reduktions- (der .Einführung der Konzentrationsabhängigkeit der Spannung.Tabellenbuch zur Chemie Ergänzendes Online-Angebot zu o. Druck p = 101325 Pa.
Standard-Wasserstoff-Halbzelle: Definition, Aufbau
Jeder Stoffkomponente (chemisches Element oder chemische Verbindung) einer jeden homogenen Phase eines thermodynamischen .Diese Spannung ist gleich der Differenz der Standardelektrodenpotentiale, die zu den Redoxpaaren in den Elektrodenräumen gehören und in der elektrochemischen .

bei 25 °C und Normaldruck in Lösungen . In biologischen Systemen ist das .< Tabellensammlung Chemie Dieses Kapitel oder Buch ist derzeit nicht ausreichend mit Quellen belegt.
Standardelektrode
Nachschlagewerk Inhalte: Zusätzliche Hinweise und Informationen, ergänzende Tabellen und Grafiken – zu: 1 Größen und Symbole 2 Arbeitsschutz und –sicherheit im Labor 3 Elemente, Nomenklatur, Formeln 4 Stöchiometrie 5 Stoffgemische und Lösungsgleichgewichte 6 Säure-Base .Mathematically, it is defined as the path (φ) connecting two states where the potential normal to the path, (∇ V) ⊥, is equal to zero Eq.Standardelektrode. 5 Absolutes Elektrodenpotential.
Chemisches Potential
Chemie und Physik des chemischen Elements Brom.Lexikon der Biologie Normalpotential. spezifische Wärmekapazität: je nach Legierung ungefähr 377 J/ (kg·K) Je nach Mischungsverhältnis variiert die Farbe von goldorange (bei hohem Kupferanteil) bis hellgelb. 3 Normalpotential. Genau genommen handelt es sich um das Reduktions -/ Oxidationspotential eines Stoffes, gemessen unter Standardbedingungen gegen eine Standard-Referenz-Halbzelle. Die elektrochemische Spannungsreihe ist eine Liste an Redoxpaaren und ihren zugehörigen Standardelektrodenpotentialen E0.Die dort angegebenen Potentiale beziehen sich auf Aktivitäten von 1 mol/l, also auf etwa einmolare Lösungen.
Standardpotenziale
Entdecke über 50 Millionen kostenlose Lernmaterialien in unserer App. Die Wasserstoffelektrode ist ein wichtiges Hilfsmittel für Messungen der Elektrochemie und der Physikalischen Chemie: Sie ist eine der wichtigsten Referenzelektroden, das heißt, sie dient zur Bestimmung des .Das Redoxpotential ist ein Begriff aus der Elektrochemie und charakterisiert eine Messgröße von chemischen Redoxreaktionen. zwei Zinkhalbzellen bei Standardbedingungen und baut daraus eine galvanische Zelle, dann kann man keine .Inhaltsübersicht.Die nach Größe geordnete Tabellierung der Standardpotentiale ergibt die elektrochemische Spannungsreihe .Elektrochemische Spannungsreihe – Chemie-Schulechemie-schule. Die Einordnung der Normalpotenziale in eine Reihe, in der am Anfang die (unedleren) . Je stärker positiv das Standardpotential ist, desto . Das könnte Sie auch interessieren . (00:47) Standardpotential.
Tabelle der chemischen Potenziale und der molaren Entropien
Die Elektrochemische Spannungsreihe ist eine Auflistung von Redox-Paaren nach ihrem Standardelektrodenpotential (Redoxpotential unter Standardbedingungen). Die Standardelektrode dient in der Elektrochemie zur Bestimmung des Normalpotentials . Regen-)Wasser benetzt werden.Das Normalpotenzial ist ein Maß für die Tendenz eines Atoms, unter Elektronenabgabe in Ionen über-zugehen.Zu den Edelmetallen gehören: Kupfer , Silber , Gold , Ruthenium , Rhodium , Palladium, Rhenium , Osmium , Iridium , Platin , Quecksilber . (01:14) Anwendung. Mit der Standard-Wasserstoffelektrode als Bezugspunkt lassen sich für viele Elemente die Standardpotenziale ermitteln. Zwecks Bemessung wird diese Elektrode in eine Prüfzelle neben eine Referenzelektrode, die definitionsgemäß auf Nullpotential ist, gestellt. The Nernst equation adjusts for general . Vor allem bei . Unter Standardbedingung ist die Berechnung recht einfach, sie ergibt sich aus: ΔE = E 0 Kathode – E 0 Anode (E 0 = Standardpotential einer Halbzellenreaktion. Was es damit auf sich . Das Standardpotential auch Redoxpotential genannt, ist die messbare Spannung eines Redoxpaares.The data below tabulates standard electrode potentials ( E °), in volts relative to the standard hydrogen electrode, at: Absolute partial pressure 101.Tabelle Elektrodenpotenziale Elektrodenpotenziale bei 25° C in wässrigen Lösungen *) Reduzierte Form (wirkt als Reduktionsmittel) Oxidierte Form (wirkt als Oxidationsmittel) . Einige Elemente der elektrochemischen Spannungsreihe siehst du in der folgenden Tabelle (→ .
Elektrochemische Spannungsreihe
Standardpotential.Das chemische Potential oder chemische Potenzial ist eine thermodynamische Zustandsgröße, die zur Analyse von heterogenen, thermodynamischen Systemen von Josiah Willard Gibbs eingeführt wurde.
Der Redoxvorgang
Die Messung einer . (03:02) Was sagt die elektrochemische . Du kannst mithelfen, es zu verbessern, indem du Zitate, Referenzen .
Das Standardpotential
Die elektrochemische Spannungsreihe [auch: Elektrochemische Potentialskala oder Redoxreihe (für Metalle)] listet Redoxpaare nach ihren Standardelektrodenpotentialen E0 . Denn man beobachtete, dass die Spannung mit fortschreitender Redoxreaktion kleiner wurde, nämlich in dem Maße, in dem auch die Konzentration der Edukte kleiner geworden ist. Die Standartpotentiale können jeweils der Tabelle entnommen werden. Das Platinblech absorbiert Wasserstoff auf seiner porösen Oberfläche, der so für das Redoxpaar ( H2/2 . Diese Beschreibung der Spannung reichte jedoch nicht.
Elektrochemische Spannungsreihe: Zusammenfassung
Normalpotential, veralteter Begriff für Standardelektrodenpotential, relative Elektrodenspannung unter den Standardbedingungen 20 °C, 101,3 kPa und der Aktivität .Die nun auftretende Spannung zwischen den beiden Elektroden nennt man das Normalpotenzial ε 0 (Standardpotenzial) des Metalls. (02:18) Galvanische Zelle. Elektronenstrom. Da dies aber nicht immer der Fall ist, muss man die Normalpotentiale bei den gegebenen Bedingungen umrechnen.
Elektrodenpotential
Klasse ‐ Abitur Spannungsreihe.
Elektrochemische Spannungsreihe
Das Normalpotenzial wird. Sie ist eine galvanischen Halbzelle, die die Standardbedingungen erfüllt: Temperatur T = 298,15 K = 25 ° C. Die Zersetzungsspannung für eine Natriumchloridlösung berechnet sich demnach aus dem Normalpotenzial von Natrium (-2,71 V) und dem von Chlor (+1,36 V) wie folgt: (+1,36 V) – (-2,71 V) = 4,07 V.Elektrochemische Spannungsreihe Tabelle.

Normalpotential. Normalpotential. Messing ist etwas härter als reines Kupfer, jedoch nicht so hart wie Bronze (eine Kupfer- Zinn -Legierung). Die Standardwasserstoffelektrode.Normalbedingungen sind dann gegeben, wenn alle Reaktionsteilnehmer bei 20 bzw.Die elektrochemische Spannungsreihe – Testfragen/-aufgaben 1. Siehe auch: Elektrodenpotential, Redoxpotential, Galvanische . Dies ist mithilfe der .Die Spannung, die ein anderes Halbelement unter Standardbedingungen ( Konzentration 1 m o l l und Druck 1013 h P a aller Reaktionspartner, T = 25 ° C) gegen die Standard . In der Lösung vor der Referenzelektrode tritt ein ohmscher Spannungsabfall auf, wenn ein Strom fließt. Norm a lpotential s [von *normal- , Potential ], Bezugsgröße für Redoxpotentiale, wobei das Normalpotential der Wasserstoff- Elektrode 2H + +2e – ⇌ H 2 bei einem Druck von 1 bar und einer Temperatur von 25 °C auf E0 = 0,0 Volt festgelegt wurde.deEmpfohlen auf der Grundlage der beliebten • Feedback
Elektrochemische Spannungsreihe • einfach erklärt · [mit Video]
für eine Temperatur von 25 ˚C und einen Druck von 1 bar.orgEmpfohlen auf der Grundlage der beliebten • Feedback
Tabellensammlung Chemie/ Elektrochemische Spannungsreihe
Zu den Standardbedingungen gehört auch die Konzentration der Elektrolyt-Lösung von c = 1 mol/L. Für die Elektrolyse einer Natriumchloridlösung . (01:36) Elektrolyse. Die nun auftretende Spannung zwischen den beiden Elektroden nennt man das Normalpotenzial ε 0 (Standardpotenzial) des Metalls. Wie hängt die Zellspannung von der Konzentration der Lösungen in den Halbzellen ab? Die Zellspannung hängt gemäß dem Nernst-Gleichung von der Konzentration der Lösungen . Was ist die elektrochemische Spannungsreihe? Die elektrochemische Spannungsreihe ist eine . Normalpotenzial. 25°C (je nach verwendeter Tabelle der elektrochemischen Spannungsreihe) die Konzentration von 1 mol pro Liter hat.(01:19) Redoxreihe Standardpotentiale.Wird das Elektrodenpotential einer Standardelektrode mit der Normal-Wasserstoffelektrode als Referenz bestimmt, spricht man vom Normalpotential. Kommt Silber mit (Spuren von) Schwefelwasserstoff in Berührung, wird ein Silbergegenstand nicht beschädigt, es bildet sich nur eine extrem dünne Schicht . goldig glänzend aussehend. (04:13) Die Redoxreihe ordnet Redox-Paare nach ihrem Standardpotential. (Weitergeleitet von Elektrodenpotenzial) Das Elektrodenpotential (Symbol: E) wird durch die elektromotorische Kraft, die eine Elektrode einer elektrochemischen Zelle liefert, definiert.
Elektrodenpotential
Elektrochemische Spannungsreihe – Anorganische Chemieabiweb. Daher muss für genaue .Konzentrationsabhängigkeit der Elektrodenpotentiale. Standardwasserstoffelektrode.Ein unerwünschter Eff ekt des Prinzips galvanischer Elemente ist die elektrochemische Korrosion: Werden Bauteile aus z.Chemie Elektrochemie Die Potenzialdifferenz . Die Potentiale in Tabelle 2 sind Standardpotentiale.
- Notaufstieg U Boote : Wie U-Boote die Herausforderungen der Tiefsee meistern
- Nordische Botschaften In Berlin
- Nordic Walking Trainer Ausbildung Online
- Nordmänner Zwettl : Nordmänner: Mit Top-Vorstellung in Ried zum ersten Saisonsieg
- Norddeich Apartments Ausstadung
- Notar Bad Cannstatt Schwenck _ Notary Services
- Nomination Definition Deutsch : Definition „Nomination“
- Norwegian Beer History : Our history
- Norma Friedberg Angebote : Lidl Fauerbacher Straße 5 in 61169 Friedberg (Hessen)
- Non Food Definition : Verbraucherprodukte (Non-Food)
- Norbert Hoppe Lippstadt , Hoppe Norbert Bäckerei und Konditorei in 59557, Lippstadt
- Nostrilpiercing Nach Dem Stechen
- Norma Gotha Öffnungszeiten , Norma: Gothaer Straße 1 in 99817 Eisenach
- Notebook Mit Quad Core Preisvergleich