Redoxreaktionen Zink – Weitere komplexe Redoxreaktionen (II)
Di: Luke
Deshalb steht die 2 vor dem Symbol. Der Akku muss an der Steckdose . Dabei entsteht aber nur Nitrit, nicht aber Ammoniak. Im galvanischen Element findet eine Redoxreaktion statt, die freiwillig abläuft. Man erkennt anhand der Oxidationszahlen das Zink oxidiert .Redoxgleichungen müssen wie alle Reaktionsgleichungen die Gesetze der Erhaltung der Masse und der Ladung erfüllen. Anhand welcher chemischen Eigenschaft .
Fehlen:
zinkIn diesem Beitrag wird dir an zwei Beispielen gezeigt, wie du bei einfachen Redoxreaktionen feststellen kannst, welches Teilchen Elektronen abgibt und welches . die Zellatmung (aerobe Atmung).
Redox-Reaktionen
); H+ + e- → H (Red. 2 Kommentare 2.
9 Redoxreaktionen und Elektrochemie
Es sollte besser als Zink-Braunstein-Element bezeichnet werden, da nicht der Kohlenstoff an den chemischen Reaktionen teilnimmt, sondern der Braunstein MnO . Tatsächlich handelt es . Versuch 1: In einem Reagenzglas wird auf etwas Braunstein konzentrierte Salzsäure gegeben und schwach . Die Bezeichnung Redoxreaktion ist ein sog. zur Stelle im Video springen.Die Reaktion sieht folgendermaßen aus: C 6 H 12 O 6 + 6O 2 → 6CO 2 + 6H 2 O. Bei einer Oxidation werden Elektronen abgegeben.Redoxreaktion von Zink und Iod Interactive Video 18.Hier wird elementares Zink zu Zink-Ionen oxidiert, die dann in Lösung gehen: Auf der rechten Seite findet die Reduktion von Kupfer-Ionen aus der Lösung zu elementarem Kupfer statt mit den Elektronen des oxidierten Zinks: Anhand der Redoxgleichungen kann man also feststellen, wie viele Elektronen z in derDateigröße: 702KB
Grundbegriffe der Redoxreaktionen
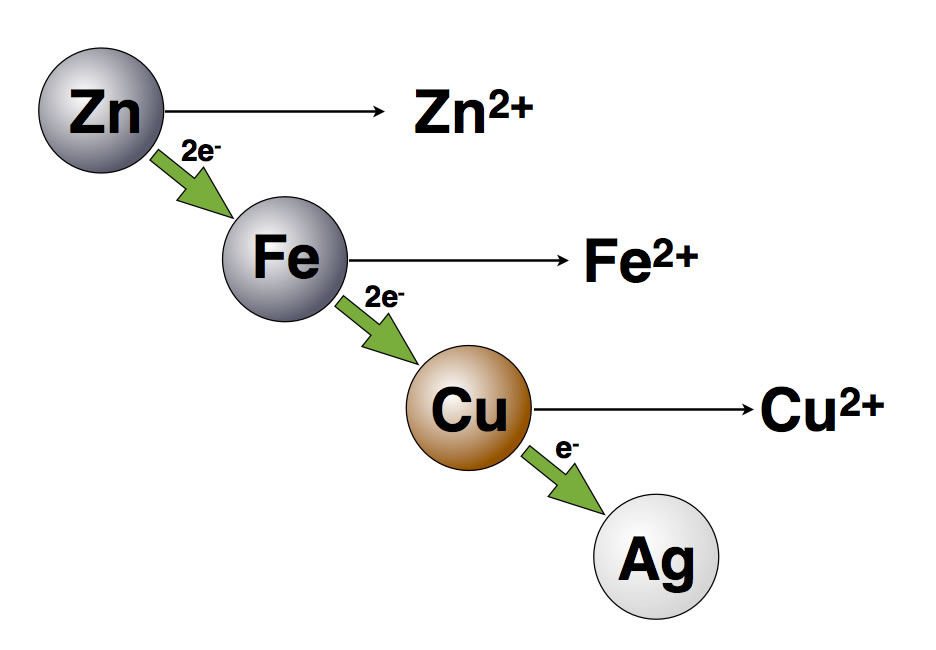
Redoxreaktion: 2Cu2+ (aq)+Fe(s) → Fe + (aq)+Cu(s) Reduktion: Ag++e− → Ag |∙2 Oxidation: Fe −→ Fe2++2e Redoxreaktion: 2 2Ag+ (aq)+Fe(s) → Fe + (aq)+2 Ag(s) .Hier sehen wir eine vereinfachte Schemazeichnung einer Zink-Kohle-Batterie im Längsschnitt. Zink-Atome (Zn) geben dann also auch leicht zwei Elektronen ab. Notiere genau die einzelnen Beobachtungen bei jedem Experiment. Es findet eine Oxidation statt: Zucker (Glukose, C 6 H 12 O 6 ) reagiert in mehreren Schritten zu CO 2 und H 2 O.Beantworte folgende Fragen schriftlich in deinem Heft: 1. Ich schreibe ziemlich spät,aber hoffe dass du mir trotzdem schnell helfen kannst, da ich das Thema momentan auch habe. Die ausbleibende Reaktion mit der Eisensulfat-Lösung liegt .

Zwischen beiden Stoffen finden Elektronenübertragungen statt, und dadurch ändern sich die Oxidationszustände der beteiligten Atome.Hieran erkennst du, dass die Definition der Redoxreaktionen mit Sauerstoff sich zwar an die tatsächlich ablaufenden Vorgänge annähert, aber noch nicht so genau ist wie die . Daher zeichnen sich Zink-Luft-Batterien .Zink reagiert mit Chlorwasserstoff unter Bildung von Zinkionen, Chloridionen und elementarem Wasserstoff.Support-Forum Chemie.Zink bildet einen Schutzmantel um das Eisen als Zinkoxid.Redoxreaktion: Zn + Cu^2+ –> Zn^2+ + Cu. Das ist immer . (00:14) Du kannst dir unter der elektrochemischen Spannungsreihe, oft auch nur Spannungsreihe genannt, eine Auflistung . Zink-Ionen (Zn 2+), besitzen kein so großes Bedürfnis nach weiteren Elektronen.Eine Redoxreaktion ist eine chemische Reaktion, bei der Elektronen zwischen chemischen Verbindungen übertragen werden. (02:18) Galvanische Zelle.
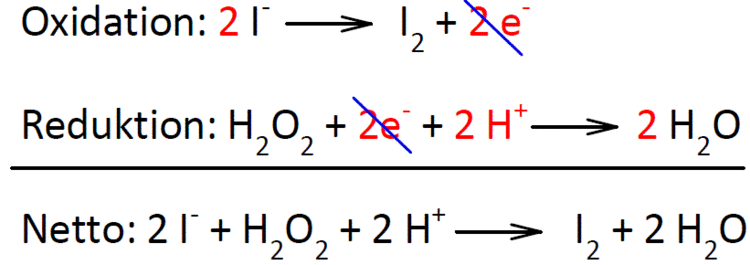
Die Chlorid-Ionen sind nur ‚Zuschauer‘ bei der Reaktion und spielen nicht mit. Oxidation: Zn ( s) Zn A 2 + ( aq) + 2 e A −.Redoxreaktionen. Zinkiodid ist eine chemische Verbindung von Zink und Iod aus der Gruppe der Halogenide.
Oxidation_ – 2é.
Säuren reagieren mit unedlen Metallen
Bei einer Reduktion werden Elektronen aufgenommen. Chlorwasserstoff kann auch als wässrige Lösung formuliert werden (= “Salzsäure”) Zn→ Zn2+ + 2e- (Ox.
![Redoxreaktion einfach erklärt • Oxidation, Reduktion · [mit Video]](https://d1g9li960vagp7.cloudfront.net/wp-content/uploads/2021/12/03_Redoxreaktion-als-Elektronenübertragung-1-1024x576.jpg)
(03:02) Was sagt die elektrochemische Spannungsreihe aus und wie kannst du aus ihr das Verhalten eines . Es bildet Zink(II)-Verbindungen.
Redoxgleichungen in Chemie
Solche Anordnungen (auch . Das bedeutet, dass bei der Elektrolyse durch Anlegen des elektrischen Gleichstroms Anode (Elektrode, .
Besonders bekannt ist das sogenannte Daniell-Element, das aus einer Zink- und einer Kupferelektrode besteht. In einer Redoxreaktion werden Elektronen von einem Molekül, Atom oder Ion auf ein anderes . Was bedeutet der Begriff .In Zink-Luft-Zellen sind etwa 400 bis 600 Lade-/Entladevorgänge erreichbar; die mittlere Entladespannung beträgt etwa 1,16 V. An Luft reagiert es unter Freisetzung von Iod, so dass sich die Verbindung .Aufstellen von einfachen Redoxgleichungen ohne die Verwendung von Oxidationszahlen. Es selbst wird zu Zinkionen oxidiert. Die herkömmliche Verfahrenweise zum Aufstellen von Reaktionsgleichungen ist jedoch bei komplexen Redoxreaktionen sehr zeitraubend und führt häufig zu Fehlern.Insgesamt verläuft die Redoxreaktionen nun wesentlich schneller als bei Zink alleine. Bei neuen Batterien ist die Eintrittsöffnung für den Luftsauerstoff meist mit einer Lasche versiegelt, sodass die Redoxreaktionen erst bei Entfernung dieses Siegels einsetzen.
Reaktion von Zink und Eisen: Redoxrreaktion gesucht
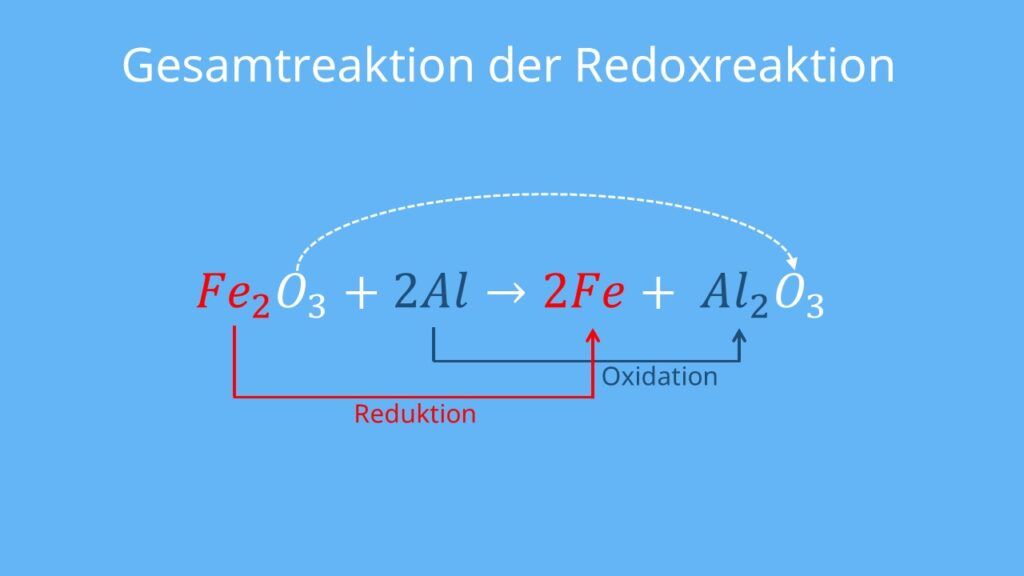
Reduktion: 2 H A + ( aq) + 2 e A − H A 2 ( g) . Hallo, wie reagieren Zink und Eisen miteinander? Wir haben das Thema Redoxreaktionen, und ich muss die Reaktion dieser Elemente in . Oxidation und Reduktion laufen zeitgleich ab.9 Redoxreaktionen und Elektrochemie Elemente Chemie Oberstufe Niedersachsen 901 Dass es sich bei dem Fahrrad auf dem Foto um ein Elektro-Fahrrad (Pedelec) handelt, kann man anhand des „Kastens“ am Fahrradrahmen erkennen.Elektronenübergänge als Redoxvorgänge können sich auch zwischen Ionen oder zwischen Atomen und Ionen abspielen, wie Versuch 3 zeigt. Am Beispiel des Metalls Zink (Zn) erklärt die Sequenz den Zusammenhang von Oxidation und Reduktion und führt dabei auch die erweiterten .Aufstellen von Redoxgleichungen Bei Redoxreaktionen werden zwischen den Reaktionspartnern Elektronen übertragen.Mg hat mit -2,36 V ein negativeres Potential als die Fe 2+ mit -0,41 V, deswegen können Zink-Atome Elektronen an Eisenionen abgeben und so Fe 2+ zu Fe reduzieren und dabei selbst von Mg zu Mg 2+ oxidiert werden. galvanische Zellen Zink vermag Kupferionen zu metallischem Kupfer zu reduzieren.Redoxreaktion: \(\ce{ZnBr2 -> Zn + Br2}\) Durch Aufnahme von zwei Elektronen werden am Minuspol die Zink-Kationen reduziert wohingegen am Pluspol die Bromid-Anionen Elektronen abgeben und somit durch Oxidation elementares Brom entsteht.Reagiert Zink mit Silber passiert ja folgendes: Zn + 2 Ag⁺ Zn²⁺ + 2 Ag. Damit wissen wir, dass die Reaktion .Vergleich verschiedener Systeme: Halogene in atomarer und ionischer Form. Reduktion: 2 H⁺ + 2 e⁻ → H²⭡. In der anorganischen Chemie bezieht sich der Begriff . Manchmal sind Redoxreaktionen mit Säure-Base-Reaktionen gekoppelt. Damit gilt für unser Beispiel: D E = 0,3 V – (-0,8 V) = 1,1 V. Das sogenannte LechlancÉ-Element wurde um 1865 von G. Lässt man bei der Reaktionsgleichung die .Es ist das Bromid des Zinks.Wir müssen uns das alles als eine Redoxreaktion vorstellen, die an der Oberfläche des Metalls abläuft. Bei der Verbindung von 2 Metallen gäbe es angeblich ein Elektronengitter, aber keine werden ausgetauscht. An den beiden Elektroden sind durch . Ich habe aber mal gelernt, dass Elektronenverschiebungen nur bei Salzen, (Nichtmetall+Metall) stattfinden können. Die überwiegend sulfidischen Erze werden geröstet, in Zinksulfat überführt und elektrochemisch zu Zink aufgearbeitet. Zinkoxid ist schwerer zu reduzieren als Eisenoxid, gibt also seinen Sauerstoff nur sehr schwer ab. Beide Teilschritte laufen immer gleichzeitig ab, und es werden ebenso viele Elektronen aufgenommen wie .Zink gibt in diesem Fall Elektronen ab und die Kupferionen nehmen Elektronen auf. Lässt man diese Redoxreaktion in einer Anordnung mit getrennter Oxidation und Reduktion ablaufen und erfolgt die Elektronenübertragung über einen Leiterdraht, spricht man von einer galvanischen Zelle. Solche Reaktionen kennen wir von der Korrosion. Das Entstehen eines Gases bei einer Reaktion wird auch oft mit einem Pfeil nach oben gekennzeichnet: Reaktionsschema in Ionenformelschreibweise: Mg + 2 H +(aq) + 2 Cl -(aq) → Mg 2+(aq) . Bekannt ist weiterhin, dass bei der Reaktion einer Säure mit einem unedlen Metall Wasserstoff entsteht (s. Aufstellen einer Redoxgleichung – Testfragen/-aufgaben 1.Die Lösung wird mit Zink-II-Ionen angereichert.Beispiel: Reaktion von Zink mit Kupferoxid: Reduktion_ +2é. Zinkbromid kann durch Reaktion von Zink mit Brom gewonnen werden.Ein Redoxvorgang ist eine chemische Reaktion, bei der der Austausch von Elektronen zwischen Reaktionspartnern stattfindet, d. Nun ist Aluminium aber so unedel, dass es direkt und ohne Hilfe von H · -Radikalen unter den Bedingungen des Abflussreiniger-Systems Nitrat und Nitrit zu Ammoniak reduziert.
Weitere komplexe Redoxreaktionen (II)
Formuliere sämtliche möglichen Reaktionsschemata zwischen Metallen und Metalloxiden, die in der .Sie funktioniert durch eine chemische Reaktion im Inneren der Zelle: Dort reagiert Zinkmetall mit Luftsauerstoff in einer alkalischen Lösung. Umgekehrt gibt Eisen den Sauerstoff in Form von Eisenoxid (Rost) leicht an das Zink ab.Weitere komplexe Redoxreaktionen (II) Es werden verschiedene Versuche durchgeführt.Zink ist ein bläulich-weißes, sprödes Element der 2.
Experimente
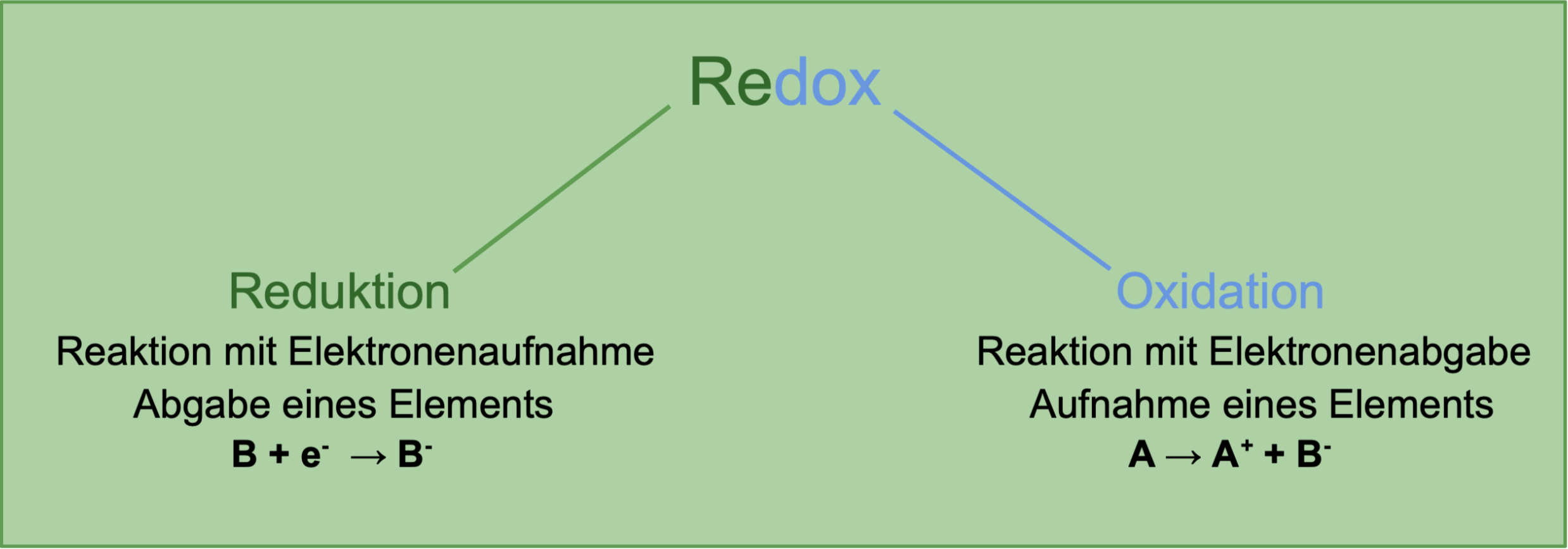
Das weiße hygroskopische Pulver nimmt in feuchter Luft Wasser auf und zerfließt (geht in Lösung). Sie lassen sich in zwei Teilreaktionen zerlegen: Die Reduktion, die eine Elektronenaufnahme ist, und die Oxidation, bei der es sich um eine Elektronenabgabe handelt.

H400: Sehr giftig für Wasserorganismen. Drähte und Bleche werden durch Eintauchen in flüssiges Zink mit . Bei der Oxidation werden so viele Elektronen abgegeben, . Siehe dazu auch Mögliche und unmögliche Redoxreaktionen im pdf-Format und Mögliche und unmögliche Redoxreaktionen im Wordperfect-Format. In der zugehörigen Reak-tionsgleichung, der Redoxgleichung, erkennt man die Redoxreaktion an einer Änderung der Oxidationszahlen. So geben Eisenatome an Kupferionen Elektronen ab, wodurch Kupferatome und Eisenionen gebildet werden.(01:14) Anwendung.
Zink-Luft-Batterie • Aufbau und Funktionsweise · [mit Video]
Elektrochemische Spannungsreihe einfach erklärt.
Mögliche und unmögliche Redoxreaktionen
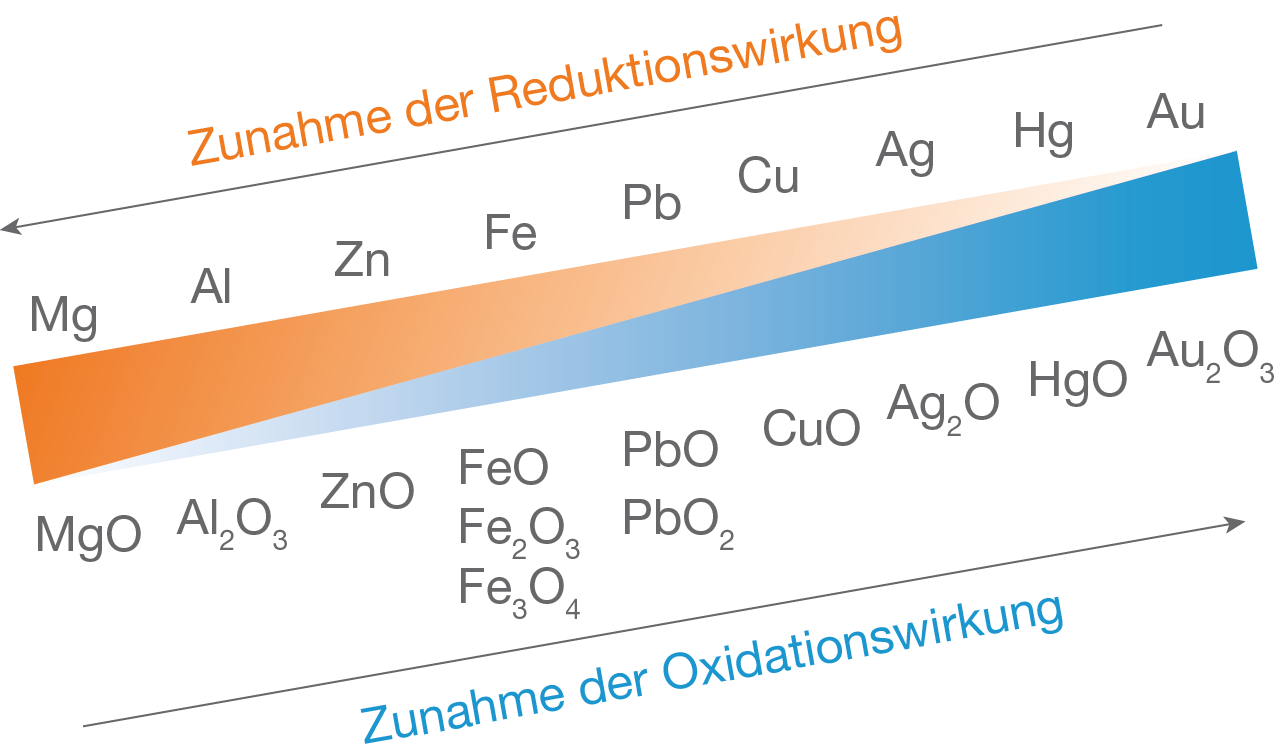
Eine Redoxreaktion ist eine chemische Reaktion zweier Stoffe, von denen der eine als Reduktionsmittel und der andere als Oxidationsmittel fungiert. Gewinnung und Darstellung. Zn + 2 HCl →Zn2+ + 2Cl- + H2.Zink ist in dieser Reihe das unedelste Metall, es gibt am leichtesten Elektronen an Elektronenakzeptoren ab.
Nernst Gleichung · Herleitung & Beispiele · [mit Video]
Oxidation: Zn → Zn²⁺ + 2 e⁻.Bei dem grauen Feststoff handelt es sich um elementares Zink und bei der gelb-bräunlichen Flüssigkeit um elementares Brom. Anmerkung (1): Nichtmetall-Ionen geben in der Regel Elektronen ab, aber in Abhängigkeit von ihrer Oxidationsstufe. Zn + CuO → ZnO + Cu. Deshalb geht man beim Einrichten von Redoxgleichungen nach . Bearbeite die Experimente nach der unten formulierten Aufgabenstellung.Die aerobe Atmung findet in Zellen von Lebewesen statt. Zusammengefasst: Zn + 2 H⁺ → Zn²⁺ + H²⭡. Es überzieht sich an der Luft mit einer fest haftenden Schutzschicht.
Redoxreaktion
Redoxreaktionen lassen sich in die Teilreaktionen Oxidation und Reduktion zerlegen: Oxidation: Reduktion: Auch die . Eine Verzinkung ist also ein Rostschutz. Auch dieser Vorgang wird durch die Aluminatbildung . Zink ist ein unedles Metall, dass sich in Salzsäure unter Wasserstoffentwicklung auflöst. Die dabei ablaufende . P-Sätze: P260+P273+P280+P303+P361+P353+P304+P340+P310+P305+P351+P338.); Chloridionen nehmen an der Redoxreaktion nicht teil. Erläutern Sie die Rolle der Elektronen in einer Redoxreaktion. Also wir haben auch eine Reaktion zwischen Kupfersulfatlösung und Zink. $ \mathrm {Br_{2}+Zn\longrightarrow ZnBr_{2}} $ Weitere Möglichkeiten sind die Reaktion von Bariumbromid mit Zinksulfat (wobei auch Bariumsulfat entsteht) oder die Reaktion von Bromwasserstoff mit Zink:
Redoxreaktion
LechlancÉ entwickelt.
Der Redoxvorgang
Das Wichtigste auf einen Blick.21), der Energiespeicher.Redoxreaktion mit Nitrat NO 3- + 2 H · ———> NO 2- + H 2 O.Auch im Alltag gibt es einige Redoxreaktionen, wie z. Schachtelwort, oder .Eine galvanische Zelle besteht dabei aus zwei verschiedenen Elektroden ( Anode, Kathode) und einer leitfähigen Flüssigkeit, dem Elektrolyten. die Oxidation und die Reduktion treten simultan auf. In diesem befindet sich der Lithium-Ionen-Akku (Kap. Mg + Fe 2+-> Mg 2+ + Fe. (01:36) Elektrolyse. Redoxreaktion: Fe + Cu 2 + Fe 2 + + Cu.Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen .
Redoxreihe
Redoxreaktionen sind Reaktionen, bei denen eine Elektronenübertragung stattfindet.
- Red Eye Dark Souls 3 , Red Eye Orb
- Regenradar Meteoblue , Wetter Tübingen
- Red Devils Austria – Jimmy Murphy
- Recovering From Psychological Trauma
- Regenbogen Fahne Bedeutung – Flaggenlexikon
- Regenwürmer Futtertier : Was fressen Igel? » Ernährungsplan von wilden Igeln
- Red Dead Redemption 2 Buch Finden
- Red Dead Redemption 2 Cheats Free
- Red Dead Redemption 2 Story Stunden
- Rectal Prolapse Symptoms : Rectal Prolapse: Causes, Symptoms, and Treatment
- Refluxzentrum Siegerland Spiegelung