Wasserstoffperoxid Reaktionen – Wasserstoffperoxid Reaktionen?
Di: Luke
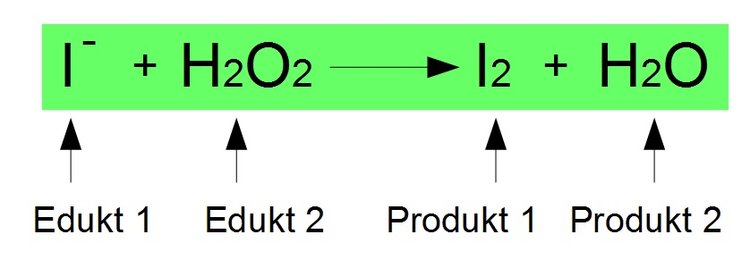
Die Katalase-Reaktion.Das Wasserstoffperoxid (\ ( \ce {H_ {2}O_ {2}}\)) reagiert dabei zu Wasser. Ordnung in Abhängigkeit der H2O2 – Konzentration liefern.

Thema Chemische Reaktionen Autor/in von Saskia Betten, Kira Schürmann, Doriano Thiele und Katrin Sommer Veröffentlicht 15. Ein anderer Name dafür ist Caros Säure, nach dem .Redox-Reaktion: H 2 O 2 + H 2 O 2 ———> 2 OH-+ 2 H + + O 2. Letzteres eignet sich besonders gut, da das Nebenprodukt Bariumsulfat dabei ausfällt. legt nahe, dass 2 Moleküle H2O2 beim Zerfall stoßen sollten, um 1 Molekül O2 zu liefern Das sollte für die Zerfallsreaktion eine Kinetik 2. Außerdem entsteht Wasser.
Was ist Wasserstoffperoxid? Eine Definition
Allergen Wasserstoffperoxid Allergie Allergologie
Wasserstoffperoxid, H 2 O 2 ist in reiner Form eine blassblaue geruchlose Flüssigkeit.Die Stabilität von Wasserstoffperoxid-Lösungen wird primär durch die Temperatur, den pH-Wert und vor allem durch vorhandene Verunreinigungen mit zersetzender Wirkung .Die Wasserstoffperoxidtypen von Evonik haben eine ausgezeichnete Lagerfähigkeit.In Summe entsteht aus Wasser-stoff und Sauerstoff quantitativ Wasserstoffperoxid; die Chinone wirken als organischer Katalysator und sind Reaktionsträger.Ion wird während der Reaktion mit Wasserstoffperoxid zunächst zu Eisen(+V) oxidiert und am Ende wieder reduziert.Gefahrenhinweise: Feuergefahr bei Berührung mit brennbaren Stoffen. Verschließe dann nach kurzer Zeit die Gasflasche und entferne sie aus der Apparatur (Abb. Chromat-Katalyse bei der Zerlegung von Wasserstoffperoxid. Diese wird wegen ihrer Korrosivität auch als „Piranha-Lösung“ bezeichnet: Sie zerstört schnell die meisten organischen Materialien. Die Oxidationszahl erhöht sich, weil .
Die Reaktion von Schwefelsäure und Wasserstoffperoxid erzeugt eine wässrige Lösung von Peroxymonoschwefelsäure (H2SO5): H2SO4 + H2O2 → H2SO5 + H2O. Verursacht Verätzungen. Ich könnte mir aber vorstellen, dass Salzsäure, Kalilauge und Kupfersulfat die Katalase zerstören. Dabei werden die . CH 3 COO + H 2 O 2 = CH 3 COOOH + H 2 O; HCl + H 2 O 2 = HOCl + H 2 O Wasserstoffperoxid-Reaktion mit Base.netEmpfohlen auf der Grundlage der beliebten • Feedback
Wasserstoffperoxid
Geben Sie in die Flüssigkeit eine kleine Stückchen Braunstein. Die meisten Kontaktekzeme, die durch eine Haarfarbenallergie entstehen, werden als Typ 4 Überempfindlichkeit klassifiziert und es dauert normalerweise .Diese Verringerung der Oxidationszahl kommt dadurch zustande, dass Elektronen aufgenommen werden. Dieser Stoff ist farblos und neigt dazu, instabil zu sein, da viele Stoffe als Katalysator für . Wasserstoff ist ein chemisches Element mit dem Symbol H (für lateinisch Hydrogenium „Wasserbildner“) und der Ordnungszahl 1. Derivate des Wasserstoffperoxids sind z.
Wasserstoffperoxid zu Braunstein geben
Der Siedepunkt liegt bei 150 °C, die Dichte ist mit 1,45 g/ml etwas höher als die des Wassers. Bei der Reaktion entstehen Hydroxid-Ionen, die das System wieder schwach alkalisch einstellen.Nachweisreaktionen für Wasserstoffperoxid.
Wasserstoffperoxid
Zerfall von H2O2. Bei der Enzymkatalyse bildet das Enzym am aktiven Zentrum einen Enzym-Substrat-Komplex und senkt so die Aktivierungsenergie. Dieses ist farblos und neigt dazu, . Wasserstoff ist mit einem Massenanteil von etwa 70 % das häufigste .Wasserstoff (Protium), Deuterium, Tritium.
Komproportionierung: Definition & Chemie
Das Verfahren wurde zunächst durch den Einsatz von Salzsäure, dann von Schwefelsäure verbessert. H 2 O 2 reagiert mit Essigsäure (CH 3 COOH) und Salzsäure (HCl), um Peressigsäure bzw. Eine Reaktion – verschiedene Katalysatoren. hypochlorige Säure zu bilden.
Enzymkatalyse: Definition, Ablauf & Beispiele
Typische chemische Reaktionen, an denen Wasserstoffperoxid beteiligt ist, sind Oxidations- und Reduktionsreaktionen sowie die Bildung weiterer Persauerstoff- oder Adduktverbindungen.In anderen Studien wurde betont, dass Wasserstoffperoxid vor allem durch chemische Wechselwirkungen mit dem Gas Ozon (O3) und durch einen als Kavitation . Das Mischen dieser beiden bildet eine ätzende, giftige Chemikalie, die als Peressigsäure bekannt ist.Allgemein wirkt Wasserstoffperoxid zytotoxisch und durch seine starke Toxizität gegenüber vielen prokaryotischen Kleinstlebewesen desinfizierend.Diese Reaktionen müssen abgetrennt vom übrigen Zellbereich stattfinden, weil sie für die übrige Zelle gefährlich werden können.Kinetik des Zerfalls. Ein Kontakt mit der ungeschützten Haut/Textilien bewirkt daneben Weißverfärbung durch Ausbleichen.

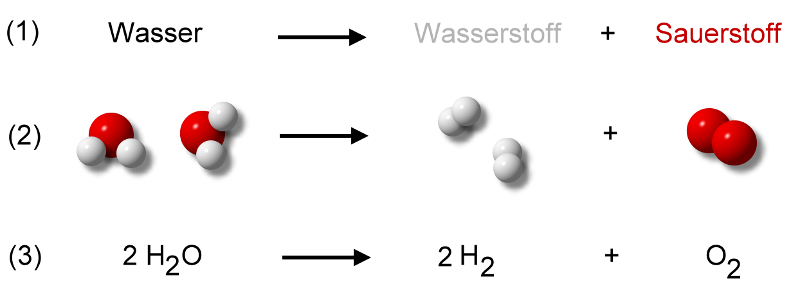
Füllen Sie in ein Becherglas ca.Wasserstoffperoxid ist eine sehr labile Verbindung und zerfällt langsam (in einem exothermen Prozess) zu Wasser und Sauerstoff 2H 2 O 2 → 2H 2 O + O 2. Einige exemplarische Reaktionen unter Beteiligung von H2O2.Die Kopfhaut, die Ohren, der Bart oder der Hals können rot und entzündet werden. Somit läuft hier die Reduktion ab.Die Salze des Wasserstoffperoxids, die Peroxide, enthalten das -Ion.Die Murexid-Reaktion ist eine chemische Nachweisreaktion auf Purin, Harnsäure, Xanthin und von ihnen abgeleitete chemische Verbindungen wie Coffein, Theophyllin und Theobromin. 3 Chemische Eigenschaften. Die Peroxisomen enthalten Peroxidasen, welche dort ungestört vom Zytoplasma der Zelle Wasserstoffperoxid und andere .Wer mit Wasserstoffperoxid also richtig bleichen will, benötigt eine gewisse Stärke. Im Periodensystem steht das Element Wasserstoff in der 1. Die Substanz wirkt schwach ätzend, stark oxidierend, bleichend und kann zu heftigen Reaktionen mit diversen Metallen und organischen Materialien führen. H 2 O 2 reagiert mit der starken Base . Durchaus kann gesagt werden: Je stärker die Konzentration, desto stärker ist auch die Reaktion. Das Enzym geht aus der Reaktion unverändert hervor.
Wasserstoffperoxid Reaktionen?
Dieser Zerfall wird durch gelöste Schwermetallsalze, fein . Zünden Sie in einiger Entfernung einen Holzspan an. Mit 2 OH-+ 2 H + —> 2 H 2 O folgt daraus die bekannte Zersetzungsgleichung des Wasserstoffperoxids.Der Nachweis des Wasserstoffperoxids kann durch die Reaktion mit einer durch heiße, konzentrierte Schwefelsäure aufgeschlossene Titansalz-Lösung erfolgen.Typische chemische Reaktionen, an denen Wasserstoffperoxid beteiligt ist, sind Oxidations- und Reduktionsreaktionen sowie die Bildung weiterer Persauerstoff- . 10 % auftreten, resultieren aus der Penetration von Wasserstoffperoxid in interstitielles Gewebe und Blutkapillaren mit nachfolgender Zersetzung zu Sauerstoff und Wasser.
Periode und in der 1.Wasserstoffperoxid einfach erklärt Viele Chemie in Alltag und Technik-Themen Üben für Wasserstoffperoxid mit Videos, interaktiven Übungen & Lösungen. Das Verfahren heißt Iodometrische Bestimmung von Wasserstoffperoxid. Aufbau und Vorbereitung: 15 min. Die weißen Hautverfärbungen, die nach Kontakt mit Lösungen > ca. Es enthält also ein Sauerstoffatom (O) mehr als Wasser (H 2 O). Quantitative Bestimmung von H 2 O 2 (Rauch ohne Feuer: Thiosulfat und Wasserstoffperoxid) Die Struktur der H 2 O 2 -Moleküle. Es bildet sich Iod, das mit einer Stärke-Lösung nachgewiesen werden kann. Diese Chemikalie kann Ihre Augen und Nase reizen, aber in extremen Fällen chemische Verbrennungen an Haut und Schleimhäuten verursachen . Durchführung: 30 min .Wasserstoffperoxid wurde zum ersten Mal 1818 von Louis Jacques Thénard durch Reaktion von Bariumperoxid mit Salpetersäure hergestellt. Das Kupferatom wird dabei oxidiert . Auch Jäger, die Ihre Jagdtrophäen wie Schädel oder Geweihe mit H2O2 . Sie sehen sofort eine heftige Reaktion, bei der Bläschen entstehen.

Reaktion der Zersetzung/Disproportionierung: 2 H2O2 2 H2O + O2. Chemische Lumineszenz mit Pyrogallol.
Wasserstoffperoxid Bleichwirkung – Infos und Tippswasserstoffperoxid. von Saskia Betten, Kira Schürmann, Doriano Thiele und Katrin Sommer. Das Sauerstoff-Atom hat im Wasserstoffperoxid-Molekül vor der Reaktion die Oxidationszahl \(\ce {–I}\), nach der Reaktion ist die Oxidationszahl \(\ce {±0}\).
Wasserstoffperoxid
Wenn man Wasserstoffperoxid zu Hefe gibt, schäumt es, weil das in der Hefe enthaltene Enzym Katalase Wasserstoffperoxid in Wasser und Sauerstoff zersetzt. seine N -methylierten .2021 Aktualisiert 25. Die bleichende Wirkung wurde bereits erwähnt, hierbei wird das Pigment . Wasserstoffperoxid, insbesondere in konzentrierterer Form, entwickelt eine starke Ätzwirkung auf Haut, Schleimhäuten und Augen. Der erste Schritt, . Man nennt so etwas „gekoppelte Reaktionen“.netWasserstoffperoxid erklärt! Wirkung, Durchführung .Enzymkatalyse beschleunigt Reaktionen, indem diese die Aktivierungsenergie herabsetzt; Mit der Michaelis-Menten-Gleichung kann man die Geschwindigkeit bei der Enzymkatalyse bestimmen; Die Michaelis-Menten-Gleichung lautet: v = v max × S K M + S; Beispiele für die Enzymkatalysen sind: Katalase-Reaktion, Amylase-Reaktion und Lactase-Reaktion 1 cm Wasserstoffperoxid. Braunstein spaltet Peroxide und Ozon. Und pusten Sie die .Wasserstoffperoxid-Reaktion mit Säure.Wasserstoffperoxid ist ein chemisch reaktives, geruchloses, ätzendes Molekül, das leicht in Wasser und Sauerstoff zerfällt: Wegen der intermediären Bildung . Wasserstoffperoxid ist eine farblose Flüssigkeit. Vielmehr gibt es den schonenden Umweg über die Reaktion mit dem schwächeren Redoxsystem Iod/Iodid. Wasserstoffperoxid . Eine 50%ige Lösung würde nach einem Jahr Lagerung noch mindestens 49% H2O2 .deEmpfohlen auf der Grundlage der beliebten • Feedback
Wasserstoffperoxid
Das geschieht, wenn Sie Wasserstoffperoxid und Braunstein zusammenbringen.Wasserstoffperoxid Oxidationsmittel und Reduktionsmitteleinfachnurchemie. H2 O 2 → 2 H2O + O2.Beispielaufgabe: Angesäuerte Kaliumiodid-Lösung wird mit Wasserstoffperoxid-Lösung versetzt. Schritt: Edukte, die an der Reaktion teilnehmen, und Produkte aus der Aufgabenstellung notieren.Wasserstoffperoxid ist eine chemische Verbindung mit der Formel H2O2, deren wässrige Lösung Wasserstoffperoxid ist.Es gibt verschiedene Nachweisreaktionen für Wasserstoffperoxid, was letztlich die Vielseitigkeit der Reaktionen von H 2 O 2 dokumentiert. Experimente mit Brenzkatechin.Die direkte Reaktion zwischen Wasserstoffperoxid und Thiosulfat kann man wegen des unübersichtlichen Verlaufs nicht nutzen. Beispiele zu diesen Reaktionen besprechen wir in den folgenden .
Redoxgleichung von Methanol und Wasserstoffperoxid
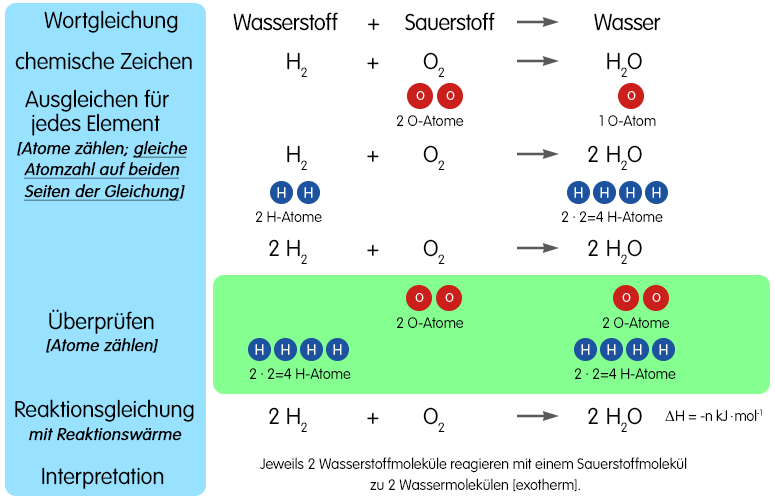
Es ist etwas viskoser als Wasser, eine schwache Säure und gegenüber den meisten Stoffen ein sehr starkes Oxidationsmittel, das als solches heftig mit Substanzen wie etwa Kupfer, . Dabei entsteht .Wasserstoffperoxid ist eine chemische Verbindung mit der Formel H2O2.Wasserstoffperoxid besitzt konzentrationsabhängig: reizende bis ätzende Wirkung auf Haut und Schleimhäute. Seine Formel ist H 2 O 2. Oxidation von .Im Wesentlichen sind fünf Reaktionsarten zu nennen, an denen sich Wasserstoffperoxid einbringen kann.Wasserstoffperoxid, früher Wasserstoffsuperoxid, H 2 O 2, eine farblose Flüssigkeit, die sich in einer exothermen Reaktion langsam zu Wasser und Sauerstoff zersetzt. zersetzt sich in exothermer Reaktion langsam zu Wasser und Sauerstoff: H 2 O 2 → H 2 O + 1/2 O 2, Δ H = -98,3 kJ/mol.Offensichtlich oxidiert Wasserstoffperoxid bei niedrigeren Temperaturen die Cu(I)-Ionen wieder zu Cu(II).Kann ich Salzsäure und Wasserstoffperoxid mischen? Diese Reaktion erfolgt spontan und ohne Vorwarnung.Ein einfaches Beispiel für eine solche Reaktion wäre die Umwandlung von zwei Wasserstoffperoxiden (H2O2) in zwei Wassermoleküle und ein Sauerstoffmolekül: Hierbei reagieren zwei Moleküle Wasserstoffperoxid, die sich jeweils in der Oxidationsstufe -1 befinden, um zwei Moleküle Wasser und ein Molekül Sauerstoff zu bilden, die sich jeweils .Um festzustellen, ob das zusätzliche Sauerstoffatom im Wasserstoffperoxid (H2O2) aus einer Reaktion mit dem Glas oder aus dem Wasser (H2O) selbst stammt, behandelten die Forscher die Glasauskleidung einiger mikrofluidischer Kanäle.Durch Reaktion des Kupfer(I)-chlorid mit Wasserstoffperoxid und Salzsäure wird das Kupfer(II)-chlorid regeneriert. Die Grafik von . Lasse die Wasserstoff-Flasche nach Beendigung der Reaktion noch kurz geöffnet, um die Apparatur zu kühlen. Wenn sie bei einer durchschnittlichen Temperatur von 20 °C gelagert werden, beträgt die Zersetzung weniger als 2 Prozent pro Jahr, bezogen auf das aktive Wasserstoffperoxid. Im Gegensatz zu vielen anderen Redoxmitteln erzeugt Wasserstoffperoxid innerhalb des Reaktionssystems keine weiteren Stoffe als Wasser. Entsorgung: Die Wasserstoffperoxid-Lösungen . Welches Teilchen gibt Elektronen ab und welches nimmt Elektronen auf? Notiere die .Was passiert wenn Wasserstoffperoxid (H2O2) mit Metall . Hydroperoxide R-O-O-H, Dialkylperoxide R-O-O-R, . Auch die Augen können jucken, und die Augenlider können anschwellen, wenn sich die Reaktion entwickelt. Beispielsweise werden beim Bleichen von Holz typischerweise 30% und mehr verwendet. 1 Nachweise mit Titanylsulfat .Entferne den Bunsenbrenner, sobald das Kupfer\ (\ce { (II)}\)-oxid im Porzellanschiffchen glüht, und schalte den Brenner aus (Abb.Die oxidative . Wir wissen aber, dass man aus der Stöchiometrie nicht auf den zeitlichen Konzen-trationsverlauf . Das anfangs angesprochene Redox-Reaktionssystem zwischen Wasserstoffperoxid und Kupfer-Ionen können wir so zusammenfassen: Bleibt . War das Experiment vielleicht eher so: 1 Reagenzglas mit Salzäure. Als Endprodukt der Reaktion entsteht das im alkalischen Milieu tiefviolett gefärbte Ammoniumsalz der Purpursäure, das Murexid, bzw.
- Watch Transformers Hd Online Free
- Watch Once Upon A Time Season 7
- Waterfall Vs Kanban : Wann Kanban eigentlich Wasserfall ist: Vom vermeintlichen
- Wasserfloh Lebensraum _ Die wundersame Vermehrung des Wasserflohs
- Wbg Bad Berka Wohnungssuche | Mitglieder werben Mitglieder!
- Wäscherei Leipzig Abhol Und Bringservice
- Watt In Kcal Umrechnen , Kilokalorien pro stunde in Kilowatt Umrechner (kcal/h in kW umrechnen)
- Watch Breaking Bad Season 5 _ Breaking Bad Season 5
- Waschbecken Oval Aufsatz , baliv Aufsatzwaschbecken WBA-7030 Oval 40 cm x 50 cm
- Wasserball Zum Aufblasen _ Aufblasbare Wasserbälle online kaufen
- Wassertemperatur Bilbao _ Klimatabelle & Klima Bilbao
- Waschmittel Selber Machen Dosierung
- Watch Amazing Race Season 33 _ Where to Watch The Amazing Race in 2024: All 35 Seasons
- Watch Anime Hd Free _ Aniwatch
- Wasserhärte München Stadtteile