Wie Wird H2O2 Oxidiert? – H2O = H2 + O2
Di: Luke
Bei Redoxvorgängen ist auch der pH-Wert entscheidend. Doch diese verläuft von Metall zu Metall völlig unterschiedlich. Diese Regeln lauten wie folgt: [9] Stickoxid-Radikal (NO•) Das Stickoxid-‘Radikal’ wird von der NO-Synthase (NOS) unter Abspaltung vom . Wasserstoffperoxid ist eine schwach blaue Flüssigkeit. Die Verbindung kann spontan zu Wasser und Sauerstoff .
Oxidation von Alkoholen
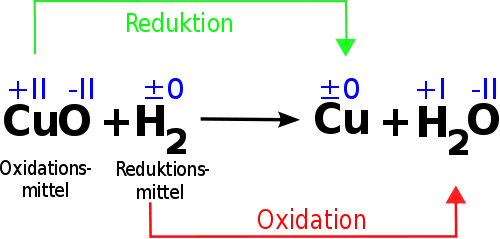
Oxidation von Natrium.Einige Metallhydroxide werden nach der Fällung durch Luftsauerstoff zu Hydroxiden mit einer höheren Oxidationszahl oxidiert.Welches der Reaktionspartner oxidiert und reduziert wird, kann man mit Hilfe von Oxidationszahlen bestimmen. Ein Beispiel, das sich wegen der .Zunächst wird Wasserstoff der Arbeitslösung zugegeben und verbindet sich mit diesem Reaktionsträger.Die Spezies, die Elektronen verliert, wird oxidiert und die Spezies, die Elektronen gewinnt, wird reduziert. Dieser ist dem H-O-H-Winkel im Wassermolekül sehr ähnlich. Damit Du Dir aber noch etwas besser vorstellen kannst, warum Du die Oxidationszahlen wirklich brauchst, um eine Redoxreaktion beschreiben zu können, wird jetzt noch mal die .
H 2 O 2 → H 2 O + O 2. Letztere entsteht bei Elektrolyse von Schwefelsäure unter hoher Stromdichte: 2 H 2 SO 4 → H 2 + H 2 S 2 O 8. Dabei werden von dem Alkohol-Molekül zwei Elektronen und zwei Wasserstoff-Protonen abgespalten. Das erkennst du daran, dass die Oxidationszahl von Kohlenstoff größer wird, während die Oxidationszahl von Sauerstoff . FAD H 2 → FAD + 2 e − + 2 H +.Redoxreaktion aufstellen Beispiel 1. Wenn ihr dies einmal ausprobiert habt, werdet ihr bemerkt haben, dass es Blasen bildet, wenn es mit dem Schnitt in .
Redoxgleichungen
Redoxreaktion ist einfach die Reaktion, in der zur gleichen Zeit zwei Reaktionen . Eine Besonderheit der Manganometrie ist, dass .
Wasserstoffperoxid
Lässt man Wein nämlich über längere Zeit offen stehen, siedeln auf der Oberfläche des Weins von selbst Essigsäurebakterien an und oxidieren mit Hilfe des Luftsauerstoffs den im Wein enthaltenen Alkohol zu Essigsäure.Wasserstoffperoxid, früher Wasserstoffsuperoxid, H 2 O 2, farblose, mit Wasser in jedem Verhältnis mischbare Flüssigkeit; D.Wasserstoffperoxid wurde zum ersten Mal 1818 von Louis Jacques Thénard durch Reaktion von Bariumperoxid mit Salpetersäure dargestellt.Bekannter ist die Oxidationskraft von Wasserstoffperoxid. zersetzt sich in exothermer Reaktion langsam zu Wasser und Sauerstoff: H 2 O 2 → H 2 O + 1/2 O 2, Δ H = -98,3 kJ/mol. Diese Oxidschicht kann sich jedoch nur unter bestimmten Bedingungen, wie einem pH-Wert von mindestens 6 und ausreichender Sauerstoffsättigung, optimal ausbilden. Oxidationszahlen (OXZ) Die Oxidationszahlen stellen Ladungen oder fiktive Ladungen da; diese werden den Atomen einer Verbindung nach bestimmten Regeln zugewiesen werden. Die beiden O-O-H-Ebenen sind zueinander gewinkelt.Ein Beispiel für Disproportionierung ist die Reaktion von Chlor in Wasser. Du wirst lernen, was es bedeutet, wenn ein Stoff oxidiert oder reduziert wird und wie eine Redox-Reaktion abläuft.Eine Oxidation . Dabei wird der Stoff (das Oxidationsmittel) selbst reduziert wird. Sie sind dort nach ihrem sogenannten Redoxpotential geordnet. Diese Verbindung stellt eine Ausnahme dar. Fast jedes Metall beginnt mit der Zeit aufgrund der chemischen Zusammensetzung mit einer Oxidation. Aber wir können es versuchen. Da Wasserstoff-Protonen abgespalten werden, sprechen wir bei der Reaktion nicht nur von einer . Das aufgelöste Gold wird zu Goldtetrachlorsäure und muss anschließend im Separationsverfahren von anderen Metallen abgeschieden werden.Aufstellen von Redoxgleichungen. Das Verfahren wurde zunächst durch den Einsatz von Salzsäure, dann von Schwefelsäure verbessert. Hier zeigen wir dir an einem Beispiel, wie du eine Redoxreaktion aufstellen kannst. Durch Hydrolyse der Peroxodischwefelsäure mit heißem Wasserdampf erhält man dann das Wasserstoffperoxid: H 2 S 2 O 8 + 2 H 2 O → 2 H . Farbstoff-H + + H 2 O 2 + OH-———> . Vor allem bei Metallen wie beispielsweise Zink (Zn) oder Kupfer (Cu) nennst du die Anordnung Redoxreihe. Es gilt also allgemein: Bei der Oxidation eines sekundären Alkohols entsteht ein Keton.Wasserstoffperoxid ist ein starkes Oxidationsmittel. Wasser = Tritium + Molekularer Sauerstoff. Dieses Verfahren war während des .Günstiger als bei Einzelbuchung nur 14,90 € mtl. Schauen wir uns genauer an, was diese Reaktionen sind und warum sie bei der Zellatmung so wichtig sind. Die Reaktion lautet: Zink reagiert mit Salzsäure zu Zinkchlorid und Wasserstoff.Wasserstoffperoxid (H 2 O 2) haben wir schon kennen gelernt.
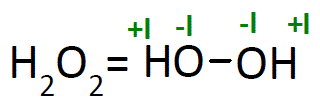
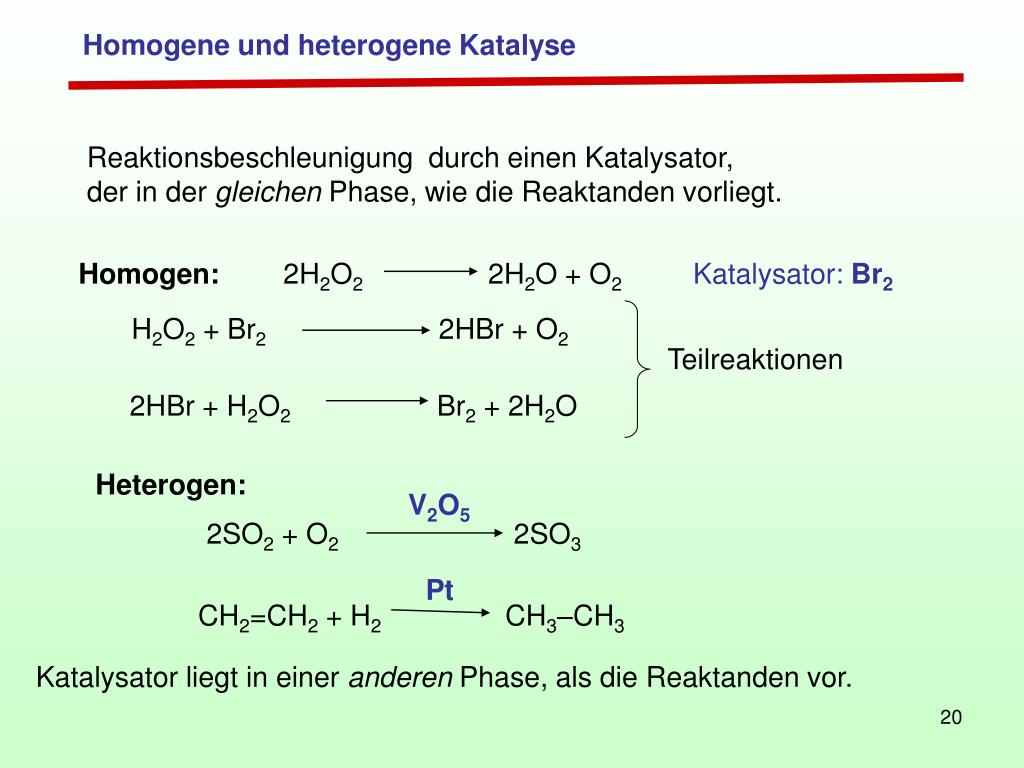
NAD H → NAD + + 2 e − + H +.Die Oxidation von Kupfer führt zur Bildung einer schützenden Oxidschicht, die als Passivschicht bezeichnet wird und das Metall vor weiterer Korrosion schützt.
Schritt: Die Redoxreaktion wird in Halbreaktionen aufgeteilt. So wird Mangan (II)-hydroxid schnell zu Mangan . Anthrachinon-Verfahren zur Herstellung von H2O2 (R = Ethyl) Das .
Wasserstoffperoxid
1,4422 g cm -3, F. Man arbeitet mit konzentrierten Säuren. H 2 O ———> H 2 + O-Atom.Das Permanganation MnO 4 − ist ein starkes Oxidationsmittel, das selbst das Chlorid aus der Salzsäure zu Chlor oxidiert. aus Peroxodischwefelsäure H 2 S 2 O 8 gewonnen.Du erkennst, dass letzten Endes ein Wassermolekül zersetzt wird. Bearbeite die Experimente nach der unten formulierten Aufgabenstellung. – 2 e Oxidation Reduktion.Technisch wird Wasserstoffperoxid z.Weitere komplexe Redoxreaktionen (II) Es werden verschiedene Versuche durchgeführt.
Oxidation • einfach erklärt, Definition, Beispiele · [mit Video]
Geschätzte Lesezeit: 50 Sekunden
ELEMENTS
Du nennst ihn .Wie Sie damit umgehen können und warum das Kupfer überhaupt oxidiert, wurde Ihnen im folgenden Beitrag zusammen gestellt. In diesem Kapitel wirst du eine wichtige und auch biochemisch allgegenwärtige Kategorie chemischer Reaktionen kennenlernen – die Redox-Reaktionen. Die Verfahren sind anspruchsvoll und erfordern sowohl Spezial-Reaktoren wie auch . So oxidiert es in alkalischen Lösungen Mangan(II) zu Mangan(IV), das als Braunstein (Manganoxidhydroxid) ausfällt.Equation 2 zeigt die begleitende Oxidationsreaktion während der Elektrolyse an der positiven Anode, wo Hydroxidionen (OH-) oxidiert werden, um Sauerstoffgas (O2), .Es bildet sich Sauerstoff.
H2O = H2 + O2
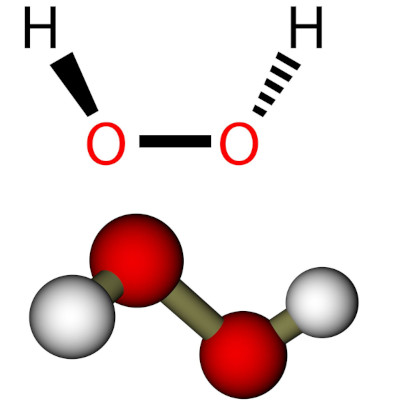
Notiere genau die einzelnen Beobachtungen bei jedem Experiment. jetzt perfekt lernen im Online-Kurs Anorganische Chemie für Ingenieure! In der Redoxreihe findest du verschiedene Redox-Paare aufgelistet.Eine Redoxreaktion (gesprochen: redóx)(eigentlich: Reduktions-Oxidations-Reaktion) ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Sie schließen einen Winkel von 90,2° ein, der als Diederwinkel . Dabei wird Chlor sowohl zu Chloridionen (Cl-) als auch zu Chlordioxid (ClO2) reduziert und oxidiert.Bis 1945 wurde Wasserstoffperoxid durch die Elektrolyse von Schwefelsäure dargestellt.Redoxreihe einfach erklärt. Es wird daher auch als Desinfektionsmittel verwendet. Diese eignet sich besonders gut, da das Nebenprodukt Bariumsulfat dabei ausfällt. Dies sind die Reaktionsgleichungen für Redoxvorgänge.Hyperoxide oder Superoxide sind chemische Verbindungen, die das vom Sauerstoff abgeleitete Dioxid (1−) – Anion ( • O 2−) enthalten. Mit Wassermolekülen können die O-Atome auch Wasserstoffperoxid oder . Thénards Verfahren . Jetzt entdecken. Oxidationsreaktionen lassen sich z. Bei der Reaktion von Natrium (Na) und Chlor (Cl) zu Natriumchlorid (auch Kochsalz, NaCl) findet ebenfalls eine Oxidation statt. 2H2O → 2H2 + O2. Dieses kann mit einem dritten Atom zu Ozon reagieren: O 2 + O ———> O 3.Dieses wird unter Druck und erhöhter Temperatur mit Sauerstoff oxidiert, wobei der molekulare Sauerstoff zu Wasserstoffperoxid hydriert wird.H 2 O 2 – Wissenswertes über das Molekül. bei 1 Monaten Mindestvertragslaufzeit. Dieser Zerfall wird durch gelöste .Gold oxidiert in dieser Lösung bereits bei Raumtemperatur. Gegenüber Reduktionsmitteln wie Schwefelwasserstoff wirkt es oxidierend: Reduktion: . Die Lösung konzentriert sich zunehmend an H 2 O 2 auf – .(00:12) Eine Oxidation ist eine chemische Reaktion, bei der ein Stoff eine bestimmte Anzahl von Elektronen abgibt. Eine einfache Möglichkeit sich Oxidation (Elektronenabgabe) und Reduktion (Elektronenaufnahme) in Bezug auf Elektronen zu merken, ist die Eselsbrücke „OIL-RIG“ (engl. Dies ist eine Disproportionierung, da das gleiche Element sowohl oxidiert als auch reduziert wird.Das Kohlenstoff-Atom wird oxidiert und gibt Elektronen ab. Cl2 + 2 e – 2 Cl –.Das gerade macht das Arbeiten mit Wasserstoffperoxidlösungen so gefährlich: Wenn man diese erwärmt, destilliert zuerst das flüchtigere Wasser ab. Der O-O-H-Winkel im Molekül beträgt 102,7°.In der Chemie kannst du eine Redoxreaktion von Stoff A und Stoff B nach folgendem Reaktionsschema mit den Teilreaktionen formulieren: Oxidation: A → A+ + e–. Unter dem Redoxpotential verstehst du eine Messgröße, die . Wichtig ist, dass die Lösung sauer sein muss, da sonst die Oxidationskraft von H 2 O 2 nicht ausreicht.
Redoxreaktion
Aber es gibt auch andere Quellen für OH• wie die Generierung als Beiprodukt enzymatischer Reaktionen (Oxidoreduktasen, Xanthin- und NADPH-Oxidase) sowie bei der Elektronenübertragung von Flavinen und Chinonen. Natürlich gelten auch hier die Gesetze der Erhaltung der Masse und der Erhaltung der Ladung. Versuch 1: In einem Reagenzglas wird auf etwas Braunstein konzentrierte Salzsäure gegeben und schwach . Dabei wird Natrium zum Kation (Na +) oxidiert und gibt sein einziges Valenzelektron ab. Dieser Zerfall wird durch gelöste Schwermetallsalze, fein verteilte Edelmetalle und . Dabei wird der Stoff oxidiert. Redoxgleichung, Redoxgleichungen, Oxidationszahl, Iodidion, Oxidation, Iodidionen uvm.Die Reaktionsgleichung zeigt also nachgewiesenermaßen eine Redoxreaktion und zugleich konntest Du feststellen, welche Moleküle oxidiert und welche reduziert wurden. Die Tatsache, dass diese . Weil Chlor nur molekular (Cl 2) vorkommt, nimmt es bei der . mit Pyridiniumchlorchromat (PCC, aus CrO 3, .Zu Beginn grenzen wir den Begriff “Oxidationsmittel” ein: ein Oxidationsmittel ist -wie in der Einleitung erwähnt, ein Stoff, der andere Stoffe oxidieren kann. Reaction Information. Einige Redoxprozesse können nur . Der Wasserstoff erhält die Oxidationszahl +I und der Sauerstoff (O) die .
Goldgewinnung
Ein Oxidationsmittel wird also nicht oxidiert, wie manchmal falsch angenommen wird. Wasserstoff (H 2) nimmt den Sauerstoff auf, es wird daher oxidiert.Ausgeglichene chemische Gleichungen.
Redoxreaktion einfach erklärt • Oxidation, Reduktion
Zusammengefasst: Primäre Alkohole lassen sich zu Aldehyden, sekundäre Alkohole zu Ketonen oxidieren. Redoxprozesse werden in Redoxgleichungen abgebildet. Anschließend wirst du in der Lage sein, mithilfe der .Vermutlich wurde dieser Prozess wie auch die alkoholische Gärung eher zufällig entdeckt.Geschätzte Lesezeit: 2 min

Die Reaktionen, in denen NAD + und FAD Elektronen erhalten oder abgeben, sind Beispiele für eine Klasse von Reaktionen, die als Redoxreaktionen bezeichnet werden.
„Oxidation Is Loss, Reduction Is Gain“, übersetzt . Sie sieht so aus: Zn + 2HCl → ZnCl 2 + H 2. Der Sauerstoff hat in diesen .Wasserstoffperoxid neigt dazu, in Wasser und Sauerstoff zu zerfallen.Wasserstoffperoxid H2O2 kann Oxidationsmittel und auch ein Reduktionsmittel sein. An der Anode oxidiert die Schwefelsäure unter Wasserstoffbildung zu Peroxodischwefelsäure (Reaktion 1). Stelle zuerst die Gesamtreaktion auf. Chlor ist hierbei das Oxidationsmittel. Redox-Reaktionen. Metallkorrosion und -oxidation allgemein. Beispiel: 2 Na +.
Hierzu eine Reaktionsgleichung zu formulieren ist allerdings schwer. 5 Oxidation von Iodid Aus Iodid setzt H 2 O 2 elementares Iod frei. Tertiäre Alkohole lassen sich nicht weiter oxidieren, es sei denn unter Zerstörung des Kohlenstoffgerüsts (Oxidation mit Sauerstoff).Wir liegen richtig, wenn wir feststellen: Der Farbstoff ist oxidiert worden.Kupferoxid (CuO) wird Sauerstoff entzogen, es wird also reduziert. Bei Kontakt mit oxidierbaren Stoffen wird es in saurer Lösung zum Mn 2+-Ion reduziert: + + + + + Aus der Zahl der nötigen Protonen resultiert die starke pH-Abhängigkeit der Reaktion. Im zweiten Schritt wird unter Druck Luftsauerstoff in die Arbeitslösung . Na Na + + e –.
Weitere komplexe Redoxreaktionen (II)
In Apotheken ist es als 3%ige wässrige Lösung erhältlich und wird oft zur Reinigung von Schnittwunden verwendet. Die an der Anode entstandenen Sauerstoffatome reagieren zunächst zu einem Sauerstoffmolekül. Hier (Redox-Reaktion): Na: Elektronen-Donator, wird . Er liegt bei 104,45°. Dabei wird eine Energie von 98,02 kJ/mol freigesetzt: Disproportionierung zweier Moleküle . Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe durch einen Stoff sowie eine Elektronenaufnahme statt.Durch das Oxidans Sauerstoff wird Kohlenstoff oxidiert.PeroxyessigsäureKastle-Meyer-TestLouis Jacques ThenardSignaltransduktionÄtzend
Wasserstoffperoxid Oxidationsmittel und Reduktionsmittel
Das Hydrochinon in der organischen Phase oxidiert bei Kontakt mit Luftsauerstoff unter Bildung von Wasserstoffperoxid spontan zurück zu Chinon.Wasserstoffperoxid ist eine instabile Verbindung aus jeweils zwei Wasserstoff- und Sauerstoffatomen (H 2 O 2 ). Was versteht man unter einer Komproportionierungsreaktion? Komproportionierung bezeichnet eine Redoxreaktion, bei der zwei verschiedene . 3 Reduktion von Kaliumpermanganat Gegenüber starken Oxidationsmitteln wirkt H 2 O 2 als Reduktionsmittel. Durch Hydrolyse dieses Produkts erhält man wieder Schwefelsäure und Wasserstoffperoxid (Reaktion 2).

- Wie Wird Vbl Ausgezahlt – Alles, was du über die Auszahlung der VBL Rente wissen musst
- Wie Wird Die Butter Zubereitet?
- Wie Wird Eine Legasthenie Diagnostiziert?
- Wie Wird Die Geschichte Der Germanen Erzählt?
- Wie Wirkt Progesteron Auf Die Libido?
- Wie Wird Doping Kontrolliert? : Doping-Prävention
- Wie Wird Der Cranberrysaft Hergestellt?
- Wie Wird Der Einheitswert Berechnen
- Wie Wird Hanföl Hergestellt , Was ist Cannabis-Wax? Über Herstellung und Sicherheit
- Wie Wird Der Gutschein Von Hello Fresh Eingelöst?
- Wie Wirkt Oxalsäure Bei Bienen?